Cho 32,8g Na3PO4 tác dụng với 51g AgNO3. Tính klg các chất còn lại sau phản ứng

Những câu hỏi liên quan
Cho 32,8g Na3PO4 tắc dụng với 51g AgNO3. Tính khối lượng các chất còn lại sau phản ứng.
PTHH: Na3PO4 + 3AgNO3 ==> 3NaNO3 + Ag3PO4 \(\downarrow\)
Ta có: \(\left\{\begin{matrix}n_{Na3PO4}=\frac{32,8}{164}=0,2\left(mol\right)\\n_{AgNO3}=\frac{51}{170}=0,3\left(mol\right)\end{matrix}\right.\)
Lập tỉ lệ: \(\frac{0,2}{1}>\frac{0,3}{3}\)
=> Na3PO4 dư, AgNO3 hết
=> Tính theo số mol của AgNO3
=> Các chất còn lại sau phản ứng là Ag3PO4, NaNO3, Na3PO4(dư)
Gợi ý phần tiếp theo:(phần này dễ)
- Đã chứng minh được AgNO3 hết, dựa vào số mol AgNO3 tính được số mol các chất còn lại
- Tính khối lượng
=> Bài toán đã xong!
Đúng 0
Bình luận (4)
\(n_{Na_3PO_4}=\frac{32,8}{164}=0,2\left(mol\right)\)
\(n_{AgNO_3}=\frac{51}{170}=0,3\left(mol\right)\)
Ta có phương trình:
Na3PO4 + 3AgNO3 -> 3NaNO3 + Ag3PO4 \(\downarrow\)
B.đầu 0,2 0,3 0 0
P.ứng 0,1 0,3 0,3 0,1
Sau p.ứng 0,1 0 0,3 0,1
=> mNaNO3 = 0,3.85 = 25,5 (g)
=> mAg3PO4 = 0,1.419 = 41,19 (g)
=> mNa3PO4(dư) = 0,1.164 = 16,4(g)
Đúng 0
Bình luận (0)
cho 32,8 g NA3PO4 tác dụng vs 51g AgNO3 . Tính khối lươngng chất còn lại sau phản ứng
Cho dung dịch HCl tác dụng lần lượt với các chất sau: CuS, dd NaHCO3, dd NaHSO4, dd NaOH, dd NaNO3, Na3PO4, Na2S, AgNO3, Ag. Số phản ứng xảy ra làA. 3 B. 6 C. 4 D. 5
Đọc tiếp
Cho dung dịch HCl tác dụng lần lượt với các chất sau: CuS, dd NaHCO3, dd NaHSO4, dd NaOH, dd NaNO3, Na3PO4, Na2S, AgNO3, Ag. Số phản ứng xảy ra là
A. 3 B. 6 C. 4 D. 5
Đáp án C
PTHH: \(HCl+NaHCO_3\rightarrow NaCl+H_2+CO_2\uparrow\)
\(HCl+NaOH\rightarrow NaCl+H_2O\)
\(Na_2S+2HCl\rightarrow2NaCl+H_2S\uparrow\)
\(AgNO_3+HCl\rightarrow AgCl\downarrow+HNO_3\)
Đúng 1
Bình luận (1)
: Cho 32,8 g Na3PO4 tác dụng với 51 g AgNO3. Tính khối lượng các chất còn lại sau phản ứng
n Na3PO4 = 32.8/164 = 0.2 mol
n AgNO3 = 51/170 = 0.3 mol
PT: Na3PO4 + 3AgNO3 → 3NaNO3 + Ag3PO4
0.1 0.3 0.3 0.1
Theo pt tỉ lệ 1 : 3 nên → Na3PO4 dư
→ m NaNO3 sau pư = 0.3 x 85 = 25.5 g
→ m Ag3PO4 sau pư = 0.1 x 419 = 41.9 g
→ m Na3PO4 dư = (0.2 - 0.1) x 164 = 16.4g
Đúng 1
Bình luận (0)
Cho dung dịch HCl tác dụng lần lượt với các dung dịch sau: Fe(NO3)2, NaF, NaOH, FeCl2, Na3PO4, CuSO4, AgNO3. Số phản ứng xảy ra là:
A. 3
B. 6
C. 4
D. 5
Fe(NO3)2 tác dụng với dung dịch HCl theo phương trình sau:
![]()
![]()
![]()
![]()
NaF tác dụng với dung dịch HCl theo phương trình sau:
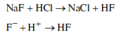
NaOH tác dụng với dung dịch HCl theo phương trình sau:
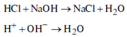
FeCl2 không có phản ứng với dung dịch HCl.
Na3PO4 tác dụng với dung dịch HCl theo phương trình sau:
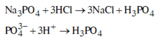
CuSO4 thì không phản ứng với dung dịch HCl.
AgNO3 tác dụng với dung dịch HCl theo phương trình sau:
![]()
Các chất phản ứng với dung dịch HCl gồm Fe(NO3)2, NaF, NaOH, Na3PO4, AgNO3.
Đáp án D
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 16 g canxi. cho chất rắn sau phản ứng tác dụng với 18,25 axit HCl. Tính khối lượng các chất còn lại sau phản ứng
Tk
2Ca + O2 -> 2CaO (1)
CaO + 2HCl -> CaCl2 + H2O (2)
nCa=0,4(mol)
nHCl=0,5(mol)
Từ 1:
nCaO=nCa=0,4(mol)
Vì 1212nHCl=0,25(mol)
mCaCl2=111.0,25=27,75(g)
mCaO=56.0,15=8,4(g)
Đúng 1
Bình luận (6)
đốt cháy hoàn toàn 8 gam Calcium, cho chất rắn sau phản ứng tác dụng với dung dịch chứa 18,25 gam acid HCL. Tính khối lượng các chất còn lại sau phản ứng?
Xem chi tiết
\(n_{Ca}=\dfrac{8}{40}=0,2mol\\ 2Ca+O_2\xrightarrow[]{t^0}2CaO\\ n_{CaO}=n_{Ca}=0,2mol\\ n_{HCl}=\dfrac{18,25}{36,5}=0,5mol\\ CaO+2HCl\rightarrow CaCl_2+H_2O\\ \Rightarrow\dfrac{0,2}{1}< \dfrac{0,5}{2}\Rightarrow HCl.dư\\ n_{CaCl_2}=n_{CaO}=0,2mol\\ n_{HCl}=2n_{CaO}=0,4mol\\ m_{CaCl_2}=0,2.111=22,2g\\ m_{HCl.dư}=\left(0,5-0,4\right).36,5=3,65g\)
Đúng 2
Bình luận (0)
Cho 6,5g kẽm tác dụng với 6,4 g lưu huỳnh theo sơ đồ:
Zn + S ---> ZnS
a/ Chất nào còn thừa sau phản ứng? khối lượng bao nhiêu?
b/ Tính khối lượng các chất còn lại sau phản ứng.
A) nZn=0,1(mol); nS=0,2(mol)
PTHH: Zn + S -to-> ZnS
Ta có: 0,2/1 > 0,1/1
=> Zn hết, S dư, tính theo nZnS
=> nZnS= nS(p.ứ)=nZn=0,1(mol)
=> nS(dư)=0,2-0,1=0,1(mol)
=>mS(dư)=0,1.32=3,2(g)
b) mZnS=0,1.81=8,1(g)
Đúng 0
Bình luận (0)
Cho 13g kẽm tác dụng với 9,6g lưu huỳnh chất tạo thành là kẽm sunfua ( ZnS)
a) Chất nào còn thừa sau phản ứng và có khối lượng bao nhiêu ?
b) Tính khối lượng các chất còn lại sau phản ứng ?
Help:(
Zn+S->ZnS
0,2-------0,2
n Zn=\(\dfrac{13}{65}\)=0,2 mol
n S=\(\dfrac{9,6}{32}\)=0,3 mol
=>S dư
=>m S=0,1.32=3,2g
=>m ZnS=0,2.97=19,4g
Đúng 2
Bình luận (0)
a. \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
\(n_S=\dfrac{9.6}{32}=0,3\left(mol\right)\)
Ta thấy : 0,2 < 0,3 => Zn đủ , S dư
PTHH : Zn + S -> ZnS
0,2 0,2 0,2
\(m_{S\left(dư\right)}=\left(0,3-0,2\right).32=3,2\left(g\right)\)
b. \(m_{ZnS}=0,2.97=19,4\left(g\right)\)
Đúng 0
Bình luận (0)
\(pthh:Zn+S\overset{t^o}{--->}ZnS\)
Ta có: \(\left\{{}\begin{matrix}n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\\n_S=\dfrac{9,6}{32}=0,3\left(mol\right)\end{matrix}\right.\)
a. Ta thấy: \(\dfrac{0,2}{1}< \dfrac{0,3}{1}\)
Vậy S dư.
Theo pt: \(n_{S_{PỨ}}=n_{Zn}=0,2\left(mol\right)\)
\(\Rightarrow m_{S_{dư}}=\left(0,3-0,2\right).32=3,2\left(g\right)\)
b. Các chất sau phản ứng: \(\left\{{}\begin{matrix}S_{dư}=3,2\left(g\right)\\ZnS\end{matrix}\right.\)
Áp dụng ĐLBTKL, suy ra:
\(m_{ZnS}=13+0,2.32=19,4\left(g\right)\)
Đúng 0
Bình luận (0)




























