cho 21,6g hỗn hợp 3 kim loại Zn, Fe, Cu trong dung dịch H2SO4 loãng, dư. Phản ứng xong, thu được 3g chất rắn không tan và 6,72l khí(đktc)
a. viết PTHH
b. xác định thành phần % của mỗi kim loại có trong hộn hợp
Câu 9: Ngâm 21,6 g hỗn hợp 3 kim loại Zn, Fe và Cu trong dung dịch H2SO4 loãng, dư. Phản ứng xong, thu được 3g chất rắn không tan và 6,72l khí (ở đktc).
a) Viết PTHH xảy ra
b) Xác định thành phần phần trăm của mỗi kim loại trong hỗn hợp
a)Zn +H2SO4 -> ZnSO4 +H2
Fe +H2SO4 -> FeSO4 +H2
Cu +H2SO4 -> CUSO4+H2
đặt số mol 3 KL Zn, Fe, Cu lần lượt là a, b, c (mol), ta có pt theo đề bài:
65a+56b+64c=21.6 (1)
c=3/64 (2)
a+b=6.72/22.4 (3)
Từ (1)(2)(3)==> a=0.2(mol), b=0.1(mol), c=3/64(mol)
==>%Zn=0.2 x 65 x100/21.6 = 60.185%
%Fe=0.1 x 56 x 100/21.6 = 25.925%
%Cu=100%-( 60.185% + 25.925% )= 13.89%
Ngâm 21,6g hỗn hợp 3 kim loại Zn ,Fe,Cu trong dung dịch H2SO4 Phản ứng thu được 3g chất rắn không tan và 6,72 lít khí đktc
Xác định % Khối lượng của mỗi chất trong hỗn hợp
phương trình bn tự ghi nha:
đặt số mol 3 KL Zn, Fe, Cu lần lượt là a, b, c (mol), ta có pt theo đề bài:
65a+56b+64c=21.6 (1)
c=3/64 (2)
a+b=6.72/22.4 (3)
Từ (1)(2)(3)==> a=0.2(mol), b=0.1(mol), c=3/64(mol)
==>%Zn=0.2x65x100/21.6=60.185%
%Fe=0.1x56x100/21.6=25.925%
%Cu=100%-(60.185%+25.925%)=13.89%
cho 21,6g hỗn hợp Zn Fe Cu phản ứng vừa đủ với mg dung dịch H2SO4 25% .sau phản ứng thu được 6,72l khí ở dktc và 3g chất rắn không tan .
A, tính % khối lượng mỗi kim loại trong hỗn hợp đầu
B, Tính m
C, Tính C% của chất rắn trong dung dịch sau phản ứng
a, \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
mhh Zn và Fe = 21,6-3 = 18,6 (g)
PTHH: Zn + H2SO4 → ZnSO4 + H2
Mol: x x
PTHH: Fe + H2SO4 → FeSO4 + H2
Mol: y y
Ta có: \(\left\{{}\begin{matrix}65x+56y=18,6\\x+y=0,3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
\(\%m_{Zn}=\dfrac{0,2.65.100\%}{21,6}=60,19\%\)
\(\%m_{Fe}=\dfrac{0,1.56.100\%}{21,6}=25,93\%\)
\(\%m_{Cu}=100-60,19-25,93=13,88\%\)
b,
PTHH: Zn + H2SO4 → ZnSO4 + H2
Mol: 0,2 0,2 0,2
PTHH: Fe + H2SO4 → FeSO4 + H2
Mol: 0,1 0,1 0,1
\(m_{H_2SO_4}=\left(0,1+0,2\right).98=29,4\left(g\right)\Rightarrow m_{ddH_2SO_4}=\dfrac{29,4.100\%}{25\%}=117,6\left(g\right)\)
c,mdd sau pư = 21,6+117,6- (0,1+0,2).2 = 138,6 (g)
\(C\%_{ddZnSO_4}=\dfrac{0,2.161.100\%}{138,6}=23,23\%\)
\(C\%_{ddFeSO_4}=\dfrac{0,1.152.100\%}{138,6}=10,97\%\)
Cho 21,6g hỗn hợp 3 kim loại Zn,Fe,Cu tác dụng với dung dịch H2SO4 loãng dư. Phản ứng xong thu được 3g a.tính thành phần % khôi lượng mỗi kim loại trong hỗn hợp b.tính thành phần % khối lượng mỗi muối trong hỗn hợp muối thu được
Sao không có bạn nào trả lời vậy ... giúp mình với
Em sai em xin lỗi ctv:))
dù gì hôm nay e cx đi hc rồi anh ko giúp thì thôi
Ngâm 21,6g một hỗn hợp gồm 3 kim loại: Zn, Fe, Cu trong dung dịch H2SO4 loãng dư. Phản ứng xong thu được 3g chất rắn không tan và 6,72l khí ở đktc.
Xác định % về khối lượng của mỗi kim loại trong hỗn hợp ban đầu.
3g chất rắn không tan là Cu
=> \(m_{Zn}+m_{Fe}=18,6\left(g\right)\)
Theo đề bài ta có PTHH:
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\) (I)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\) (II)
Gọi \(n_{Zn}=x\left(mol\right);n_{Fe}=y\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}65x+56y=18,6\\x+y=0,3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=56\cdot0,1=5,6\left(g\right)\) ; \(m_{Zn}=65\cdot0,2=13\left(g\right)\)
\(\%m_{Fe}=\dfrac{5,6}{21,6}\cdot100\%=25,93\left(\%\right)\)
\(\%m_{Zn}=\dfrac{13}{21,6}\cdot100\%=60,19\left(\%\right)\)
\(\%m_{Cu}=\left(100-25,93-60,19\right)\%=13,88\%\)
Cho 21,6g hỗn hợp (Zn, Fe, Cu) phản ứng vừa đủ với dd H2SO4, sau phản ứng thu được 3g chất rắn không tan và 6,72 lít khí (đktc)
a) Viết PTHH
b) Tính % khối lượng của mỗi kim loại
c) Tính khối lượng dd H2SO4 25% cần dùng
a) Đặt: nZn=x(mol); nFe= y(mol) (x,y: nguyên, dương)
Zn + H2SO4 -> ZnSO4 + H2
x_______x_______x________x
Fe + H2SO4 -> FeSO4 + H2
y____y_________y___y(mol)
b) m(rắn)=mCu=3(g)
=> m(Zn, Fe)= 21,6 - 3= 18,6(g)
Ta có hpt:
\(\left\{{}\begin{matrix}65x+56y=18,6\\22,4x+22,4y=6,72\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
=> Zn= 65.0,2=13(g)
=>%mZn= (13/21,6).100=60,185%
%mCu=(3/21,6).100=13,889%
=>%mFe=25,926%
c) nH2SO4=x+y=0,3(mol) =>mH2SO4=29,4(g)
=> mddH2SO4= (29,4.100)/25=117,6(g)
Nung nóng 3,72g hỗn hợp bột các kim loại Zn và Fe trong bột S dư. Chất rắn thu được sau phản ứng được hòa tan hoàn toàn bằng dung dịch H2SO4 loãng, nhận thấy có 1,344 lít khí (đktc) thoát ra. Xác định khối lượng mỗi kim loại trong hỗn hợp ban đầu.
Đặt nZn = x mol; nFe = y mol.
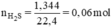
Ta có hệ phương trình: 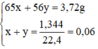
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g
Cho 10g hỗn hợp hai kim loại Cu và Zn vào 100ml dung dịch H2SO4 loãng dư, người ta thu được 2,24 lít khí (đktc); biết rằng Cu không phản ứng dung dịch H2SO4 loãng. a) Tính thành phần % theo khối lượng của các kim loại trong hỗn hợp ban đầu. b) Tính nồng độ mol (CM) của dung dịch H2SO4 đã dùng.
Zn+ H2SO4→ ZnSO4+ H2↑
(mol) 0,1 0,1 0,1
a)
\(n_{H_2}=\dfrac{V}{22,4}=\dfrac{2,24}{22,4}=0,1\left(lít\right)\)
→mZn=n.M=0,1.65= 6,5(g)
→mCu= 10- 6,5= 3,5(g)
=> \(\%m_{Zn}=\dfrac{6,5}{10}.100\%=65\%\)
\(\%m_{Cu}=100\%-65\%=35\%\)
b) \(C_{M_{H_2SO_4}}=\dfrac{n}{V}=\dfrac{0,1}{0,1}=1M\)
Cho 11,6g hỗn hợp gồm Fe và một kim loại R (II) vào dung dịch H2SO4 loãng (dư) thu được 5,6l khí H2 (dktc). Nếu cho 3g R thì phản ứng không hết 1,12l khí O2 a) Xác định R b) Tính phần trăm về khối lượng của mỗi kim loại trong hỗn hợp
a)Thí nghiệm 2 :
$2R + O_2 \xrightarrow{t^o} 2RO$
n O2 = 1,12/22,4 = 0,05(mol)
n R < 2 n O2 = 0,1(mol)
=> R > 3/0,1 = 30(1)
Thí nghiệm 2 : n H2 = 5,6/22,4 = 0,25(mol)
n R = a(mol)
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$R + H_2SO_4 \to RSO_4 + H_2$
n Fe = 0,25 - a(mol)
Suy ra :
(0,25 - a).56 + Ra = 11,6
=> R = (56a - 2,4)/a
Mà 0 < a < 0,25
Suy ra : R < 46,6(2)
Từ (1)(2) suy ra : 30 < R < 46,6
Suy ra R là Ca(R = 40)
b) (0,25 -a)56 + 40a = 11,6
=> a = 0,15
%m Ca = 0,15.40/11,6 .100% = 51,72%
%m Fe = 100% -51,72% = 48,28%