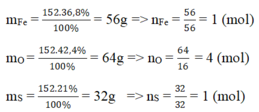bài 1: hợp chất A có tỉ khối so với H2 là 22. Hãy cho biết 5,6 lít khí A ở(đktc) có khối lượng là bao nhiêu gam?bài 2: tìm công thữ hóa học của những hợp chất có thành phần nguyên tố như sau:a) hợp chất A tạo bởi 2 nguyên tố: C và O có khối lượng mol là 44(g?mol),trong đó cacbon chiếm 27,3% về khối lượng,còn lại là % Ob) hợp chất B tạo bởi 3 nguyên tố: Na,C,O có khối lượng mol là 44(g/mol), thành phần các nguyên tố lần lượt là: 43,4% Na,11,3% C,45,3%c) một hợp chất khí A có thành phần % theo khố...
Đọc tiếp
bài 1: hợp chất A có tỉ khối so với H2 là 22. Hãy cho biết 5,6 lít khí A ở(đktc) có khối lượng là bao nhiêu gam?
bài 2: tìm công thữ hóa học của những hợp chất có thành phần nguyên tố như sau:
a) hợp chất A tạo bởi 2 nguyên tố: C và O có khối lượng mol là 44(g?mol),trong đó cacbon chiếm 27,3% về khối lượng,còn lại là % O
b) hợp chất B tạo bởi 3 nguyên tố: Na,C,O có khối lượng mol là 44(g/mol), thành phần các nguyên tố lần lượt là: 43,4% Na,11,3% C,45,3%
c) một hợp chất khí A có thành phần % theo khối lượng: 82,35% N,17,65% H. Hợp chất A có tỉ khối với H2 là 8,5. Hãy cho biết:
- CTHH của hợp chất A
- số mol nguyên tử của các nguyên tố có trong 0,5 mol hợp chất A.