Hấp thụ hoàn toàn 6.72 lít CO2 vào 200 ml dung dịch Ba(OH)2 thu được 19,7 gam kết tủa. Tính nồng độ của dung dịch Ba(OH)2

Những câu hỏi liên quan
Hấp thụ hoàn toàn 6.72 lít CO2 vào 200 ml dung dịch Ba(OH)2 thu được 19,7 gam kết tủa. Tính nồng độ của dung dịch Ba(OH)2
\(n_{CO_2}=0,3\left(mol\right);n_{BaCO_3}=0,1\left(mol\right)\)
Bảo toàn nguyên tố C => \(n_{Ba\left(HCO_3\right)_2}.2+n_{BaCO_3}=n_{CO_2}\)
=> \(n_{Ba\left(HCO_3\right)_2}=0,1\left(mol\right)\)
Bảo toàn nguyên tố Ba : \(n_{Ba\left(OH\right)_2}=n_{BaCO_3}+n_{Ba\left(HCO_3\right)_2}=0,2\left(mol\right)\)
=> \(CM_{Ba\left(OH\right)_2}=\dfrac{0,2}{0,2}=1M\)
Đúng 1
Bình luận (0)
Hấp thụ hoàn toàn V lít CO2 (đktc) vào dung dịch chứa a mol Ba(OH)2 thì thu được 19,7 gam kết tủa. Hấp thụ hoàn toàn V lít CO2 (đktc) vào dung dịch chứa a mol Ba(OH)2 và a mol NaOH thì thu được 39,4 gam kết tủa. Giá trị của V và a tương ứng là A. 5,60 và 0,2 B. 6,72 và 0,1 C. 8,96 và 0,3 D. 6,72 và 0,2
Đọc tiếp
Hấp thụ hoàn toàn V lít CO2 (đktc) vào dung dịch chứa a mol Ba(OH)2 thì thu được 19,7 gam kết tủa. Hấp thụ hoàn toàn V lít CO2 (đktc) vào dung dịch chứa a mol Ba(OH)2 và a mol NaOH thì thu được 39,4 gam kết tủa. Giá trị của V và a tương ứng là
A. 5,60 và 0,2
B. 6,72 và 0,1
C. 8,96 và 0,3
D. 6,72 và 0,2
Chọn D
nCO2 dùng ở 2 thí nghiệm là như nhau nhưng TN2 cho nhiều BaCO3 hơn TN1
Þ Trong dung dịch sau phản ứng của TN1 còn Ba2+ cùng với CO32− hoặc HCO3-
Þ Dung dịch sau phản ứng của TN1 chỉ có Ba(HCO3)2.
Vậy ở TN1 bản chất là giống thí nghiệm 1 tạo ra 0,1 mol BaCO3 và dung dịch có a – 0,1 mol Ba(HCO3)2
Lượng NaOH thêm vào là a > nBa(HCO3)2 Þ Toàn bộ Ba2+ đã kết tủa
Þ a – 0,1 = 0,1 Þ a = 0,2; BTNT.C Þ nCO2 = 0,1 + 0,1.2 = 0,3 Þ V = 6,72.
Đúng 0
Bình luận (0)
Hấp thụ hoàn toàn 5,6 lít CO2 vào dung dịch 85,5 gam dung dịch Ba(OH)2. Sau phản ứng lọc tách kết tủa thu được dung dịch có khối lượng 39,95 gam. Tính nồng độ phần trăm của dung dịch Ba(OH)2
: Hấp thụ hoàn toàn V lít CO2 (đkc) vào dung dịch Ba(OH)2 thu được 19,7 gam kết tủa. Loại bỏ kết tủa rồi thêm vào dung dịch còn lại một lượng H2SO4 dư lại được thêm 23,3 gam kết tủa. Tính V.
Đọc tiếp
: Hấp thụ hoàn toàn V lít CO2 (đkc) vào dung dịch Ba(OH)2 thu được 19,7 gam kết tủa. Loại bỏ kết tủa rồi thêm vào dung dịch còn lại một lượng H2SO4 dư lại được thêm 23,3 gam kết tủa. Tính V.
Ta có: nBaCO3 = 0,1 (mol)
nBaSO4 = 0,1 (mol)
- TH1: Pư chỉ tạo muối trung hòa và Ba(OH)2 dư.
PT: \(Ba\left(OH\right)_2+CO_2\rightarrow BaCO_3+H_2O\)
_______________0,1_____0,1 (mol)
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4+2H_2O\)
⇒ nCO2 = 0,1 (mol) ⇒ VCO2 = 0,1.24,79 = 2,479 (l)
- TH2: Pư tạo cả 2 muối.
PT: \(Ba\left(OH\right)_2+CO_2\rightarrow BaCO_3+H_2O\)
______________0,1_____0,1 (mol)
\(Ba\left(OH\right)_2+2CO_2\rightarrow Ba\left(HCO_3\right)_2\)
____________0,2_______0,1 (mol)
\(Ba\left(HCO_3\right)_2+H_2SO_4\rightarrow BaSO_4+2CO_2+2H_2O\)
___0,1___________________0,1 (mol)
⇒ nCO2 = 0,1 + 0,2 = 0,3 (mol)
⇒ VCO2 = 0,3.24,79 = 7,437 (l)
Đúng 1
Bình luận (0)
Dung dịch X là dung dịch Ba(OH)2 có nồng độ x mol/l. Hấp thụ hoàn toàn 2,464 lít khí CO2 (ở đktc) vào 200ml dung dịch X, thu được 3a gam kết tủa. Mặt khác, nếu hấp thụ hoàn toàn 3,136 lít khí CO2 (ở đktc) vào 200ml dung dịch X, thu được 2a gam kết tủa. Tính x
Ba(OH)2 + CO2 -> BaCO3 + H2O (1)
BaCO3 + CO2 + H2O -> Ba(HCO3)2 (2)
TN1: 2,464 lít CO2 (đktc) vào 200ml dung dịch X thì thu được 3a gam kết tủa.
TN2: 3,136 lít CO2 (đktc) vào 200ml dung dịch X thì thu được 2a gam kết tủa
=> Lượng CO2 ở TN2 tăng mà kết tủa lại giảm
*TN1: Chỉ xảy ra (1)
nCO2 = 0,11 mol
nBa(OH)2 = 0,2x mol
=> nBaCO3 (1) = 0,2 x mol
=> 3a = 0,2x . 197 = 39,2 x (I)
* TN2: Xảy ra cả (1)(2)
nCO2 = 0,14 mol
=> nCO2 (2) = 0,14 - 0,11 = 0,3 mol
=> nBaCO3 (2) = 0,3 mol
=> nBaCO3 còn lại = 0,2 x - 0,3 mol
=> 2a = (0,2 x - 0,3).197 = 39,2x - 59,1
=> 3a = (39,2x - 59,1). 1,5 = 58,8x - 88,65 (II)
Từ (I) và (II) => 39,2 x = 58,8x - 88,65
=> x = 4,5 M
Đúng 0
Bình luận (0)
Hấp thụ hoàn toàn 1,12 lít khí CO2 (ở đktc) vào 200 ml dung dịch Ca(OH)2 nồng độ X mol/l, thu được 1 gam kết tủa. Giá trị của X là A.0,3. B.0,15. C.0,6. D.0,4.
Đọc tiếp
Hấp thụ hoàn toàn 1,12 lít khí CO2 (ở đktc) vào 200 ml dung dịch Ca(OH)2 nồng độ X mol/l, thu được 1 gam kết tủa. Giá trị của X là
A.0,3.
B.0,15.
C.0,6.
D.0,4.
Hấp thụ hoàn toàn 2,688 lít CO2 (đktc) vào 2,5 lít dung dịch Ba(OH)2 nồng độ a mo/l, thu được 15,76 gam kết tủa. Giá trị của a là
A. 0,04.
B. 0,048.
C. 0,06.
D. 0,032.
Hấp thụ hoàn toàn 2,688 lít CO2 (đktc) vào 2,5 lít dung dịch Ba(OH)2 nồng độ a mo/l, thu được 15,76 gam kết tủa. Giá trị của a là A. 0,04. B. 0,048. C. 0,06. D. 0,032
Đọc tiếp
Hấp thụ hoàn toàn 2,688 lít CO2 (đktc) vào 2,5 lít dung dịch Ba(OH)2 nồng độ a mo/l, thu được 15,76 gam kết tủa. Giá trị của a là
A. 0,04.
B. 0,048.
C. 0,06.
D. 0,032
Đáp án A
nCO2 = 0,12;
nBaCO3 = 0,08 → Ba(HCO3)2 = 0,02 (BT.C)
BT.Ba
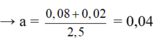
Đúng 0
Bình luận (0)
Hấp thụ hoàn toàn 2,688 lít CO2 (đktc) vào 2,5 lít dung dịch Ba(OH)2 nồng độ a mo/l, thu được 15,76 gam kết tủa. Giá trị của a là A. 0,04 B. 0,048 C. 0,06 D. 0,032
Đọc tiếp
Hấp thụ hoàn toàn 2,688 lít CO2 (đktc) vào 2,5 lít dung dịch Ba(OH)2 nồng độ a mo/l, thu được 15,76 gam kết tủa. Giá trị của a là
A. 0,04
B. 0,048
C. 0,06
D. 0,032