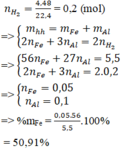Hòa tan 13,9g hỗn hợp gồm Al và Fe trong 500ml H2SO4 ,sau phản ứng thu được 7,84lit khí (đktc) . Tính thành phần% theo khối lượng của các khối lượng trong hỗn hợp đầu

Những câu hỏi liên quan
Hòa tan 20,65 gam hỗn hợp kim loại Al, Fe bằng dd axit H2SO4 loãng dư thu được 16,24 lít khí hidro (đktc). Xác định thành phần phần trăm khối lượng của mỗi kim loại trong hỗn hợp, tính khối lượng axit đã phản ứng và khối lượng muối sinh ra
n Al = a(mol) ; n Fe = b(mol)
=> 27a + 56b = 20,65(1)
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
a...........1,5a............0,5a............1.5a..(mol)
Fe + H2SO4 → FeSO4 + H2
b...........b..............b............b......(mol)
=> n H2 = 1,5a + b = 0,725(2)
Từ 1,2 suy ra a = 0,35 ; b = 0,2
Suy ra :
%m Al = 0,35.27/20,65 .100% = 45,76%
%m Fe = 100% -45,76% = 54,24%
m H2SO4 = (1,5a + b).98 = 71,05 gam
m muối = m kim loại + m H2SO4 -m H2 = 20,65 + 71,05 -0,725.2 = 90,25 gam
Đúng 1
Bình luận (0)
1/ Cho 0,83g hổn hợp gồm Al và Fe tác dụng với dd H2SO4 loãng dư, sau phản ứng thu được 0,56 lit khí ( đktc)a) Viết phương trình phản ứng.b) Tính thành phần % theo khối lượng của hổn hợp ban đầu.2/ Hòa tan 4,5g hợp kim Al - Mg trong dd H2SO4 loãng dư, thấy có 5,04 lít khí H2 bay ra ( đktc).a) Viết phương trình phản ứng hóa học xãy ra.b) Tính thành phần % khối lượng của mỗi kim loại trong hổn hợp ban đầu. Dạng: PHƯƠNG PHÁP HAI DÒNG1/ Cho 9,2g một kim loại A phản ứng với khí...
Đọc tiếp
1/ Cho 0,83g hổn hợp gồm Al và Fe tác dụng với dd H2SO4 loãng dư, sau phản ứng thu được 0,56 lit khí ( đktc)
a) Viết phương trình phản ứng.
b) Tính thành phần % theo khối lượng của hổn hợp ban đầu.
2/ Hòa tan 4,5g hợp kim Al - Mg trong dd H2SO4 loãng dư, thấy có 5,04 lít khí H2 bay ra ( đktc).
a) Viết phương trình phản ứng hóa học xãy ra.
b) Tính thành phần % khối lượng của mỗi kim loại trong hổn hợp ban đầu.
Dạng: PHƯƠNG PHÁP HAI DÒNG
1/ Cho 9,2g một kim loại A phản ứng với khí clo (dư) tạo thành 23,4g muối. Xác định tên kim loại A, biết A có hóa trị I
Câu 1:
Đặt \(n_{Al}=x(mol);n_{Fe}=y(mol)\Rightarrow 27x+56y=0,83(1)\)
\(n_{H_2}=\dfrac{0,56}{22,4}=0,025(mol)\\ 2Al+3H_2SO_4\to Al_2(SO_4)_3+3H_2\\ Fe+H_2SO_4\to FeSO_4+H_2\\ \Rightarrow 1,5x+y=0,025(2)\\ (1)(2)\Rightarrow x=y=0,01(mol)\\ \Rightarrow \%_{Al}=\dfrac{0,01.27}{0,83}.100\%=32,53\%\\ \Rightarrow \%_{Fe}=100\%-32,53\%=67,47\%\)
Câu 2:
Đặt \(n_{Al}=x(mol);n_{Mg}=y(mol)\Rightarrow 27x+24y=4,5(1)\)
\(n_{H_2}=\dfrac{5,04}{22,4}=0,225(mol)\\ 2Al+3H_2SO_4\to Al_2(SO_4)_3+3H_2\\ Mg+H_2SO_4\to MgSO_4+H_2\\ \Rightarrow 1,5x+y=0,225(2)\\ (1)(2)\Rightarrow x=0,1(mol);y=0,075(mol)\\ \Rightarrow \%_{Al}=\dfrac{0,1.27}{4,5}.100\%=60\%\\ \Rightarrow \%_{Mg}=100\%-60\%=40\%\)
Dạng PP hai dòng:
\(PTHH:2A+Cl_2\to 2ACl\\ \Rightarrow n_A=n_{ACl}\\ \Rightarrow \dfrac{9,2}{M_A}=\dfrac{23,4}{M_A+35,5}\\ \Rightarrow M_A=23(g/mol)\)
Vậy A là natri
Đúng 3
Bình luận (0)
Hòa tan hoàn toàn 18,2 g hỗn hợp gồm bột Al và Fe trong lọ đựng dung dịch NaOH dư sau phản ứng thu được 12,8 g chất rắn Tính thành phần phần trăm theo khối lượng của kim loại Al có trong hỗn hợp ban đầu
\(m_{cr}=m_{Fe}=12.8\left(g\right)\)
\(NaOH+Al+H_2O\rightarrow NaAlO_2+\dfrac{3}{2}H_2\)
\(m_{Al}=m_{hh}-m_{Fe}=18.2-12.8=5.4\left(g\right)\)
\(\%m_{Al}=\dfrac{5.4}{18.2}\cdot100\%=29.67\%\)
Đúng 1
Bình luận (0)
Al pư NaOH, Fe không pư NaOH nhé, nên chất rắn sau pư là Fe
\(2Al + 2NaOH + 2H_2O \rightarrow 2NaAlO_2 + 3H_2\)
\(m_{Al}= m_{hh} - m_{Fe}= 18,2 - 12,8 = 5,4 g\)
%mAl=\(\dfrac{5,4}{18,2} . 100\)% = 29,67%
Đúng 0
Bình luận (0)
Câu 1 :Tính thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp đầu. Khi cho một hỗn hợp gồm nhôm và sắt cân nặng 41,5g cho hòa tan vào dung dịch H2SO4 loãng dư. Sau phản ứng thu được 28 lít khí đo ở đktc.
Câu 2 : một hỗn hợp gồm 2 kim loại Mg và Ag cân nặng 27,6g hoà tan trong dung dịch Hcl vừa đủ, sau phản ứng thấy thoát ra 5,6 lít ở đktc. Thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp ban đầu lần lượt là
Đọc tiếp
Câu 1 :Tính thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp đầu. Khi cho một hỗn hợp gồm nhôm và sắt cân nặng 41,5g cho hòa tan vào dung dịch H2SO4 loãng dư. Sau phản ứng thu được 28 lít khí đo ở đktc.
Câu 2 : một hỗn hợp gồm 2 kim loại Mg và Ag cân nặng 27,6g hoà tan trong dung dịch Hcl vừa đủ, sau phản ứng thấy thoát ra 5,6 lít ở đktc. Thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp ban đầu lần lượt là

Câu 1:
Gọi số mol Al, Fe là a,b (mol)
=> 27a + 56b = 41,5
\(n_{H_2}=\dfrac{28}{22,4}=1,25\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
______a-------------------------->1,5a_______(mol)
Fe + 2HCl --> FeCl2 + H2
b---------------------------->b_______________(mol)
=> 1,5a + b = 1,25
=> \(\left\{{}\begin{matrix}a=0,5\\b=0,5\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{56.0,5}{41,5}.100\%=67,47\%\\\%m_{Al}=\dfrac{27.0,5}{41,5}.100\%=32,53\%\end{matrix}\right.\)
Đúng 4
Bình luận (0)
Câu 1:
Đặt \(n_{Al}=x(mol);n_{Fe}=y(mol)\Rightarrow 27x+56y=41,5(1)\)
\(n_{H_2}=\dfrac{28}{22,4}=1,25(mol)\\ PTHH:2Al+3H_2SO_4\to Al_2(SO_4)_3+3H_2\\ Fe+H_2SO_4\to FeSO_4+H_2\\ \Rightarrow 1,5x+y=1,25(2)\\ (1)(2)\Rightarrow x=y=0,5(mol)\\ \Rightarrow \%_{Fe}=\dfrac{0,5.56}{41,5}.100\%\approx 67,5\%\\ \Rightarrow \%_{Al}=100\%-67,5\%=32,5\%\)
Chọn D
Đúng 3
Bình luận (11)
Câu 2:
\(PTHH:Mg+2HCl\to MgCl_2+H_2\\ \Rightarrow n_{Mg}=n_{H_2}=\dfrac{5,6}{22,4}=0,25(mol)\\ \Rightarrow \%_{Mg}=\dfrac{0,25.24}{27,6}.100\%=21,74\%\\ \Rightarrow \%_{Ag}=100\%-21,74\%=78,26\%\)
Chọn A
Đúng 2
Bình luận (0)
Xem thêm câu trả lời
Hòa tan hoàn toàn 5,5 gam hỗn hợp gồm Al và Fe vào lượng dư dung dịch H 2 SO 4 loãng, thu được 4,48 lít H 2 (đktc). Thành phần phần trăm khối lượng của Fe trong hỗn hợp đầu là
A. 50,91%
B. 76,36%
C. 25,45%
D. 12,73%
Hòa tan hoàn toàn 5,5 gam hỗn hợp gồm Al và Fe vào lượng dư dung dịch H2SO4 loãng, thu được 4,48 lít H2 (đktc). Thành phần phần trăm khối lượng của Fe trong hỗn hợp đầu là:
A. 50,91%
B. 76,36%
C. 25,45%
D. 12,73%
Đáp án A
n H 2 = 0 , 2 ( m o l )
=> mhh= mFe + mAl
Bảo toàn electron:
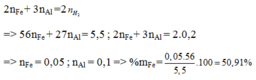
Đúng 0
Bình luận (0)
Hòa tan 12g hỗn hợp gồm Al, Ag vào dung dịch
H
2
SO
4
loãng, dư. Phản ứng kết thúc thu được 13,44 lít khí
H
2
(đktc). Thành phần % khối lượng của Al, Ag trong hỗn hợp lần lượt là A. 70% và 30% B. 90% và 10% C. 10% và 90% D. 30% và 70%
Đọc tiếp
Hòa tan 12g hỗn hợp gồm Al, Ag vào dung dịch H 2 SO 4 loãng, dư. Phản ứng kết thúc thu được 13,44 lít khí H 2 (đktc). Thành phần % khối lượng của Al, Ag trong hỗn hợp lần lượt là
A. 70% và 30%
B. 90% và 10%
C. 10% và 90%
D. 30% và 70%
Đáp án B
Cho Al và Ag phản ứng với H 2 S O 4 loãng, dư chỉ có Al phản ứng.
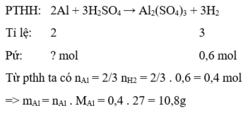
% m A l = 10,8 12 .100 % = 90 % .
% m A g = 100 % - 90 % = 10 %
Đúng 0
Bình luận (0)
Hòa tan 12g hỗn hợp gồm Al, Ag vào dung dịch H2SO4 loãng, dư. Phản ứng kết thúc thu được 13,44 lít khí H2 (đktc). Thành phần % khối lượng của Al, Ag trong hỗn hợp lần lượt là
\(n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
_____0,4<-----------------------------------0,6
=> \(\%Al=\dfrac{0,4.27}{12}.100\%=90\%\)
%Ag = 100% - 90% = 10%
Đúng 3
Bình luận (0)
1/ Cho 0,83g hổn hợp gồm Al và Fe tác dụng vừa đủ với dd H2SO4 20%, sau phản ứng thu được 0,56 lit khí H2 ( đktc)
a) Tính thành phần % theo khối lượng mỗi kim loại trong hỗn hợp ban đầu.
b) Tính khối lượng dung dịch h2so4 20% đã dùng
a, Ta có: 27nAl + 56nFe = 0,83 (1)
PT: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Fe}=\dfrac{0,56}{22,4}=0,025\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow n_{Al}=n_{Fe}=0,01\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,01.27}{0,83}.100\%\approx32,53\%\\\%m_{Fe}\approx67,47\%\end{matrix}\right.\)
b, nH2SO4 = nH2 = 0,025 (mol)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,025.98}{20\%}=12,25\left(g\right)\)
Đúng 3
Bình luận (0)