đố cháy hỡn hợp gồm 6,4g lưu huỳnh và 3,6 cacbon trong õi dư thu đc sản phẩm SO2 và CO2
viết phương trình phản ứng
Cho hỗn hợp A gồm cacbon và lưu huỳnh tác dụng với khí oxi dư. Sau phản ứng thu được 4,48 lít (ở đktc) hỗn hợp B gồm SO2 và CO2 . Thể tích khí oxi( ở đktc) đã tham gia phản ứng là bn lít ?
n hh=\(\dfrac{4,48}{22,4}\)=0,2 mol
=>n O2=n hh=0,2 mol
=>VO2=0,2.22,4=4,48l
\(n_B=\dfrac{4,48}{22,4}=0,2mol\)
\(C+O_2\underrightarrow{t^o}CO_2\)
\(S+O_2\underrightarrow{t^o}SO_2\)
\(\Rightarrow n_B=\Sigma n_{O_2}=0,2mol\)
\(\Rightarrow V_{O_2}=0,2\cdot22,4=4,48l\)
nSO2 + nCO2 = 4,48/22,4 = 0,2 (mol)
PTHH:
S + O2 -> (t°) SO2
C + O2 -> (t°) CO2
Từ PTHH => nO2 (sử dụng) = nCO2 + nSO2 = 0,2 (mol)
=> VO2 = 0,2 . 22,4 = 4,48 (l)
Đốt cháy 5 gam hỗn hợp bột gồm cacbon C và lưu huỳnh S trong bình chứa khí oxi dư, thu được 13 gam hỗn hợp sản phẩm là CO2 và SO2. Tính thể tích khí oxi (đktc) đã phản ứng.
C + O2 → CO2
x → x → x
S + O2 → SO2
y → y → y
{12x+32y=544x+64y=13=>x=0,15 ,y=0,1
∑nO2(1) +(2) = x + y = 0,15 + 0,1 = 0,25 (mol)
=>VO2(ĐKTC) = 0,25.22,4 = 5,6 (lít)
Gọi x, y lần lượt là số mol của C và S ( x,y > 0)
C + O2 → CO2 (1)
x.....x.........x
S + O2 → SO2 (2)
y......y.........y
Từ (1) và (2) ta có hệ phương trình
\(\left\{{}\begin{matrix}12x+32y=5\\44x+64y=13\end{matrix}\right.\)
⇒ x = 0,15 ; y = 0,1
Ta có
nO2 = 0,15+ 0,1 = 0,25 ( mol )
⇒ VO2 = 0,25 . 22,4 = 5,6 (l)
đốt cháy 3,2g lưu huỳnh trong bình đựng 1,12 lít khí O2
a, viết PTPƯ, gọi tên và phân loại sản phẩm
b,tính thể tích khí SO2 thu đc sau phản ứng ở điều kiện tiêu chuẩn
Bài 4: Đốt cháy hoàn toàn 6,4 gam Lưu huỳnh trong 6,72 lít khí Oxi (đktc).
a. Viết phương trình hóa học.
b. Sau phản ứng, chất nào còn dư? Dư bao nhiêu gam?
c. Tính khối lượng sản phẩm thu được sau phản ứng?
a, PTHH: S + O2 -> (t°) SO2
b, nS = 6,4/32 = 0,2 (mol)
nO2 = 6,72/22,4 = 0,3 (mol)
LTL: 0,2 < 0,3 => O2 dư
nO2 (pư) = nSO2 = nS = 0,2 (mol)
mO2 (dư) = (0,3 - 0,2) . 32 = 3,2 (g)
c, mSO2 = 64 . 0,2 = 12,8 (g)
a, \(S+O_2\underrightarrow{t^o}SO_2\)
\(nS=\dfrac{6,4}{32}=0,2\left(mol\right)\)
\(nO_2=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(\dfrac{0,2}{1}< \dfrac{0,3}{1}\) => oxi dư
\(nO_{2\left(dư\right)}=0,1\left(mol\right)\)
\(mO_{2\left(dư\right)}=0,1.32=3,2\left(g\right)\)
\(nSO_2=nS=0,2\left(mol\right)\)
\(mSO_2=0,2.64=12,8\left(g\right)\)
S+O2--t-->SO2
nO2=6,72:22,4=0,3(mol)
nS=6,4: 32=0,2(mol)
Lập Tỉ Lệ : 0,2 < 0,4
=> O2 dư
theo pt , n S = nSO2 = 0,2 (mol)
=> mSO2 = n.M= 0,2. (32+16.2)=12,8 (g)
a)
\(S + O_2 \xrightarrow{t^o} SO_2\)
b)
\(n_{O_2} = n_{SO_2} = n_S = \dfrac{3,2}{32} = 0,1(mol)\)
Suy ra:
\(m_{O_2} = 0,1.32 = 3,2(gam)\\ V_{SO_2} = 0,1.22,4 = 2,24(lít)\)
Để đốt cháy hoàn toàn 4,48 lít hỗn hợp khí X gồm CH4 và C2H4 cần dùng vừa đủ 11,2 lít khí oxi, sau phản ứng thu được sản phẩm gồm khí cacbon đioxit và hơi nước.
a) Viết các phương trình phản ứng xảy ra.
b) Tính % thể tích mỗi khí trong hỗn hợp X. Biết các thể tích khí đo ở đktc.
Đốt cháy 5g hỗn hợp bột gồm C và S trong bình chứa khí oxi dư, sau phản ứng thu được 13 gam hỗn hợp sản phẩm là CO2 và SO2 .
a. Tính thành phần % thể tích khí trong hỗn hợp ban đầu .
b. Tính thể tích khí oxi (đktc) đã phản ứng.
a, \(C+O_2\underrightarrow{t^o}CO_2\)
\(S+O_2\underrightarrow{t^o}SO_2\)
Gọi: \(\left\{{}\begin{matrix}n_C=x\left(mol\right)\\n_S=y\left(mol\right)\end{matrix}\right.\)
Ta có: 12x + 32y = 5 (1)
Theo PT: \(\left\{{}\begin{matrix}n_{CO_2}=n_C=x\left(mol\right)\\n_{SO_2}=n_S=y\left(mol\right)\end{matrix}\right.\) ⇒ 44x + 64y = 13 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,15\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\)
%V cũng là %n ở cùng điều kiện nhiệt độ, áp suất.
Nếu là %V thì phải là hh sản phẩm chứ bạn nhỉ?
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CO_2}=\dfrac{0,15}{0,15+0,1}.100\%=60\%\\\%V_{SO_2}=40\%\end{matrix}\right.\)
b, Theo ĐLBT KL: mC + mS + mO2 = mCO2 + mSO2
⇒ mO2 = 13 - 5 = 8 (g) \(\Rightarrow n_{O_2}=\dfrac{8}{32}=0,25\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,25.22,4=5,6\left(l\right)\)
hỗn hợp A gồm 16g bột lưu huỳnh và 28g bột sắt, nung nosngh hỗn hợp thu đc FeS
a,viết phương thức phản ứng
b, tính khối lượng của sản phẩm
a) Fe + S → FeS
b) Áp dụng định luật bảo toàn khối lượng:
mFe+mS = mFeS
\(\Rightarrow\) mFeS= 16 + 28
= 44g
nFe = 0,5 mol
nS= 0,5 mol
Fe + S --> FeS
0,5 0,5 0,5
mFeS= 0,5.88=44g
nS = 16 : 32 = 0.5 mol
nFe = 0.5 mol
S + Fe -> FeS
mol : 0.5 : 0.5
mFeS = 0.5 x 88 = 44 g
Một nhà máy phát điện vận hành bằng các đốt cháy nhiên liệu phức hợp có công thức trung bình là C11H7S. Giả sử nguồn không khí cung cấp chỉ chứa N2 và O2 có tỷ lệ mol 3,76:1,00 và N2 không cho phản ứng. Ngoài nước tạo thành, lượng cacbon trong nhiên liệu được chuyển hóa hoàn toàn thành CO2 và lưu huỳnh chuyển hóa thành SO2.
(a) Viết phương trình phản ứng cháy của C11H7S.
(b) Để phản ứng cháy xảy ra hoàn toàn, thực tế cần dùng dư 20% lượng oxy so với tỷ lượng lý thuyết. Tính khối lượng (kg) và thể tích (ở đktc, m3) không khí cần sử dụng để đốt cháy hoàn toàn 1 tấn C11H7S.
(c) Tính tổng khối lượng CO2 và SO2 tạo thành trong điều kiện của câu (b) trên

Do lấy dư 20% oxi so với lượng cần đốt cháy nên lượng oxi đã lấy là:


Tổng khối lượng CO2 và SO2 :
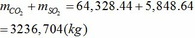
Chú ý:
Lượng O2 lấy dư 20% so với với lượng cần thiết => tính mol O2 chính xác