4) Hòa tan hoàn toàn 14,4g một kim loại R (hóa trị II) bằng dd HCl thu được 13,44lit khí H2 (đktc). Kim loại R là:

Những câu hỏi liên quan
Bài 24. Hòa tan 3,6g một kim loại A hóa trị II bằng một lượng dư axit HCl thu được 3,36 lít khí H2 (đktc). Xác định tên kim loại ABài 25. Hòa tan hoàn toàn 8,1g kim loại A hóa trị III trong dd HCl dư thu đucợ 10,08 lít khí H2 (đktc). Xác định tên A và m HCl đã dùng
Đọc tiếp
Bài 24. Hòa tan 3,6g một kim loại A hóa trị II bằng một lượng dư axit HCl thu được 3,36 lít khí H2 (đktc). Xác định tên kim loại A
Bài 25. Hòa tan hoàn toàn 8,1g kim loại A hóa trị III trong dd HCl dư thu đucợ 10,08 lít khí H2 (đktc). Xác định tên A và m HCl đã dùng
Bài 24:
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ PTHH:A+2HCl\rightarrow ACl_2+H_2\uparrow\)
Theo pthh: nA = nH2 = 0,15 (mol)
=> MA = \(\dfrac{3,6}{0,15}=24\left(\dfrac{g}{mol}\right)\)
=> A là Mg
Bài 25:
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\\ PTHH:2A+6HCl\rightarrow2ACl_3+3H_2\uparrow\\ Mol:0,3\leftarrow0,9\leftarrow0,3\leftarrow0,45\\ \rightarrow\left\{{}\begin{matrix}M_A=\dfrac{8,1}{0,3}=27\left(\dfrac{g}{mol}\right)\Rightarrow A:Al\\m_{HCl}=0,9.36,5=32,85\left(g\right)\end{matrix}\right.\)
Đúng 2
Bình luận (1)
Bài 24.
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(n_A=\dfrac{3,6}{M_A}\) mol
\(A+2HCl\rightarrow ACl_2+H_2\)
0,15 0,15 ( mol )
\(\Rightarrow\dfrac{3,6}{M_A}=0,15mol\)
\(\Leftrightarrow M_A=24\) ( g/mol )
=> A là Magie ( Mg )
Bài 25.
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45mol\)
\(n_A=\dfrac{8,1}{M_A}\) mol
\(2A+6HCl\rightarrow2ACl_3+3H_2\)
0,3 0,45 ( mol )
\(\Rightarrow\dfrac{8,1}{M_A}=0,3\)
\(\Leftrightarrow M_A=27\) g/mol
=> A là nhôm ( Al )
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 1,52g hỗn hợp gồm 2 kim loại là Fe và R(có hóa trị II) trong dd HCl 15% vừa đủ, thu được 672ml khí (đktc) và dd B. Nếu hòa tan 1,52g kim loại R trong 49gam dd H2SO4 8% thì lượng axit còn dư. a,Xác định tên kim loại R b,Tính thành phần % về khối lượng mỗi kim loại trong hỗn hợp ban đầu c, Tính nồng độ % của các chất trong dd B
a)
Fe +2 HCl --> FeCl2+ H2
R + 2HCl --> RCl2 + H2
nhh = nH2= 0,672/22,3=0,03 mol
=> M trung bình =1,52/ 0,03= 50,6
Vì MFe=56> Mtb => R<50,6
nH2SO4= 49.8%/98= 0,04 mol
R + H2SO4 --> RSO4 +H2
axit dư => nR phản ứng = nH2SO4 phản ứng <0,04
=> R>1,52/0,04= 38
Suy ra 38< R< 50,6, R hóa trị II
Vậy R là Canxi (Ca) . R =40
b)
Có nFe +nCa= 0,03mol
m hh=56nFe +40nCa =1,52
=> n Fe = 0,02 mol ; n Ca = 0,01 mol
=> %mFe, %mCa
c)
nHCl = 2nH2 =0,06 mol
=> mddHCl =36,5.0,06.100/15=14,6g
mddB= m hhkl + m ddHCl - mH2 = 1,52+ 14,6 -0,03.2= 16,06 g
dd B có FeCl2 0,02 mol và CaCl2 0,01 mol
=> C%.
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 1,52g hỗn hợp gồm 2 kim loại là Fe và R(có hóa trị II) trong dd HCl 15% vừa đủ, thu được 672ml khí (đktc) và dd B. Nếu hòa tan 1,52g kim loại R trong 49gam dd H2SO4 8% thì lượng axit còn dư. a,Xác định tên kim loại R b,Tính thành phần % về khối lượng mỗi kim loại trong hỗn hợp ban đầu c, Tính nồng độ % của các chất trong dd B
Hòa tan 1,52g hh Fe và kim loại R có hóa trị II trong dd HCl 15% vừa đủ thu được 0,672lit khí (đktc) và dd B. Nếu hòa tan 1,52g kim loại R trong 49g dd H2SO4 8% thì lượng axit còn dư
a) xác định kl A
==========
Fe +2 HCl --> FeCl2+ H2
R + 2HCl --> RCl2 + H2
nhh = nH2= 0,672/22,3=0,03 mol
=> M trung bình =1,52/ 0,03= 50,6
Vì MFe=56> Mtb => R<50,6
nH2SO4= 49.8%/98= 0,04 mol
R + H2SO4 --> RSO4 +H2
axit dư => nR phản ứng = nH2SO4 phản ứng <0,04
=> R>1,52/0,04= 38
Suy ra 38< R< 50,6, R hóa trị II
Vậy R là Canxi (Ca) . R =40
Có nFe +nCa= 0,03mol
m hh=56nFe +40nCa =1,52
=> n Fe = 0,02 mol ; n Ca = 0,01 mol
=> %mFe, %mCa
c) tính nồng độ phần trăm của các chất trong dd B
nHCl = 2nH2 =0,06 mol
=> mddHCl =36,5.0,06.100/15=14,6g
mddB= m hhkl + m ddHCl - mH2 = 1,52+ 14,6 -0,03.2= 16,06 g
dd B có FeCl2 0,02 mol và CaCl2 0,01 mol
=> C%=bạn tự làm nha
Đúng 1
Bình luận (0)
bài 1:cho 7,2g kim loại hóa trị II phản ứng hoàn toàn 100ml dung dịch HCL 6M. Xác định tên kim loại đã dùng
baì 2: hòa tan hoàn toàn 7,56g kim loại R có hóa trị III vào dung dịch axit HCL thu được 9,408 lít H2 (đktc). Tìm kim loại R
Giúp mik vs ạ ! Cảm ơn
Bài 1:
Gọi KL cần tìm là A.
PT: \(A+2HCl\rightarrow ACl_2+H_2\)
Ta có: \(n_{HCl}=0,1.6=0,6\left(mol\right)\)
Theo PT: \(n_A=\dfrac{1}{2}n_{HCl}=0,3\left(mol\right)\)
\(\Rightarrow M_A=\dfrac{7,2}{0,3}=24\left(g/mol\right)\)
Vậy: KL cần tìm là Mg.
Đúng 1
Bình luận (0)
Bài 2:
PT: \(2R+6HCl\rightarrow2RCl_3+3H_2\)
Ta có: \(n_{H_2}=\dfrac{9,408}{22,4}=0,42\left(mol\right)\)
Theo PT: \(n_R=\dfrac{2}{3}n_{H_2}=0,28\left(mol\right)\)
\(\Rightarrow M_R=\dfrac{7,56}{0,28}=27\left(g/mol\right)\)
Vậy: R là Al.
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 4 gam hỗn hợp gồm Fe và một kim loại M có hóa trị II trong hợp chất vào dd HCl dư thu được 2,24l khí H2 ( đktc).Nếu chỉ dùng 2,4 gam kim loại M trên cho vào dd HCl thì dùng không hết 0,5 mol HCl. Xác định kim loại M.
\(Fe\left(x\right)+2HCl\left(2x\right)\rightarrow FeCl_2+H_2\left(x\right)\)
\(M\left(y\right)+2HCl\left(2y\right)\rightarrow MCl_2+H_2\left(y\right)\)
Gọi số mol của Fe, M lần lược là x,y thì ta có
\(56x+My=4\left(1\right)\)
\(n_{H_2}=\frac{2,24}{22,4}=0,1\)
\(\Rightarrow x+y=0,1\left(2\right)\)
Nếu chỉ dùng 2,4 g M thì
\(n_{HCl}=2n_M=\frac{2.2,4}{M}=\frac{4,8}{M}< 0,5\left(3\right)\)
Từ (1), (2), (3) ta có hệ: \(\left\{\begin{matrix}56x+My=4\\x+y=0,1\\\frac{4,8}{M}< 0,5\end{matrix}\right.\)
\(\Leftrightarrow\left\{\begin{matrix}56\left(0,1-y\right)+My=4\\x=0,1-y\\\frac{4,8}{M}< 0,5\end{matrix}\right.\)
\(\Leftrightarrow\left\{\begin{matrix}y\left(56-M\right)=1,6\\x=0,1-y\\M>9,6\end{matrix}\right.\)
\(\Rightarrow9,6< M< 56\)
Tới đây thì chọn kim loại nào có hóa trị II mà nằm trong khoản đó và kiểm tra thỏa mãn hệ phương trình là xong.
Đúng 1
Bình luận (8)
Hung Nguyen: giải thích hộ mình ở chỗ dấu ngoặc nhọn thứ 2 đc ko. mình ko hiểu từ dấu ngoặc nhọn thứ nhất làm thế nào để ra đc dấu ngoặc nhọn thứ 2. cảm ơn trước nha ![]()
Đúng 0
Bình luận (2)
hòa tan hoàn toàn 9,75 gam kim loại R (II) vào dd HCl vừa đủ thì thu được 3,7175 lít khí H2 (đkc). xác định kim loại R
\(n_{H2}=\dfrac{3,7175}{24,79}=0,15\left(mol\right)\)
Pt : \(R+2HCl\rightarrow RCl_2+H_2|\)
1 2 1 1
0,15 0,15
\(n_R=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
⇒ \(M_R=\dfrac{9,75}{0,15}=65\) (g/mol)
Vậy kim loại R là Kẽm
Chúc bạn học tốt
Đúng 4
Bình luận (0)
Hòa tan hoàn toàn 6 gam một kim loại M hóa trị II vào dung dịch HCl, sau phản ứng thu được 3,36 lit khí H 2 (đktc). Kim loại M là:
A. Zn (65)
B. Mg (24)
C. Fe (56)
D. Ca (40)
Chọn D
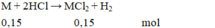
M M = 6 : 0 , 15 = 40 .
Vậy kim loại M là Ca.
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 0.5 hỗn hợp gồm fe và 1 kim loại hóa trị (II) bằng dd HCL dư thu dc 1,12 lít H2 (đktc) tìm kim loại hóa trị (II)
Gọi số mol Fe là x, kim loại cần tìm là A, hóa trị 2 và A tác dụng được với HCl có số mol là y
Fe -2e ------> Fe+2
x ; 2x (mol)
A -2e --------> A+2
y ; 2y (mol)
2H+ +2e ------> H2
0.1(mol)
mình có hệ:
(1) x +y = 0,05
(2) 56x + Ay = 0,5
rút x theo y từ một thế vào 2 đc biểu thức:
y = 2,3 / (56 - A) (*)
từ (*) để A>0 thì A phải nhỏ hơn 56
tiếp tục để x > 0 thì y < 0.05
=> A<10<56. A la Be.
=> Chọn B
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 0,5 gam Fe và một kim loại hóa trị II trong dung dịch HCl thu được 1,12 lít khí H2 đktc. Kim loại hóa trị II đó là kim loại nào sau đây.
A. Mg.
B. Ca.
C. Zn.
D. Be.
Đáp án D.
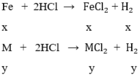
gọi x, y lần lượt là số mol của Fe và M trong hỗn hợp
số mol H2 là 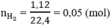
theo bài ra ta có hệ phương trình
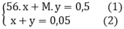
từ (2) → x= 0,05 – y
thay vào (1) ta được 56(0,05 – y) + My = 0,5
⇔ 2,8 – 56y + My = 0,5
2,3 = 56y – My
→ y = 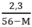
Ta có 0 < y < 0,05
y > 0 ↔ 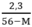 > 0 → 56 – M > 0 ⇒ M < 56
> 0 → 56 – M > 0 ⇒ M < 56
y < 0,05 ↔ 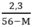 < 0,05 → 2,3 < 0,05(56 – M) → M < 10
< 0,05 → 2,3 < 0,05(56 – M) → M < 10
Trong các kim loại hóa trị II chỉ có Be thỏa mãn do đó M là Be
Đúng 0
Bình luận (0)

























