Khử 1 oxit sắt bằng hydro ở nhiệt độ cao, phản ứng xong thu được 0,84g Fe và 0,36g H2O. Xác định công thức và tính thể tích H2 ở ĐKTC

Những câu hỏi liên quan
khử một oxit sắt bằng hidro ở nhiệt độ cao. Phản ứng xong thu được 0,84g sắt và 0.36 g nước. a. xác định CTHH của oxit sắt. b. Tính thể tích H2 tham gia phản ứng
Cho oxit sắt có công thức là: \(Fe_xO_y\)
\(n_{H2O}=\frac{0,36}{18}=0,02\left(mol\right)\)
\(n_{Fe}=\frac{0,84}{56}=0,015\left(mol\right)\)
Bảo toàn \(H,\) ta có:
\(N_{h2}=n_{H2O}=0,02\left(,ol\right)\)
Bảo toàn khối lượng, ta có:
\(m_{Fe_zO_y}=m_{H2O}+m_{Fe}-m_{H2}\)
\(\Rightarrow m_{Fe_zO_y}=0,84+0,36-0,02.2=1,16g\)
a) Phương trình:\(Fe_xO_y\)\(+\)\(yH_2\)\(→^{t^o}\)\(xFe\)\(+\)\(yH_2O\)
Ta nhận thấy: \(n_{Fe_zO_y}=\frac{^nFe}{x}=\frac{0,015}{x}\left(mol\right)\)
\(\Rightarrow M_{Fe_zO_y}=\frac{1,16}{\frac{0,015}{x}}=\frac{232}{3}\left\{x\right\}\)
\(\Rightarrow56x+16y=\frac{232}{3}x\)
\(\Rightarrow16y=\frac{64}{3}x\)
Ta có: \(x\le3,y\le4|x,y>0\)
+) Với \(x=1\rightarrow y=\frac{4}{3}\)( loại )
+) Với \(x=2\rightarrow y=\frac{8}{3}\)( loại )
+) Với \(x=3\rightarrow y=4\)( nhận )
Vậy oxit có công thức: \(Fe_3O_4\)
b) \(V_{H2}=0,02.22,4=0,448\left(l\right)\)
dùng khí h2 vừa đủ để khử hoàn toàn 34,8g một oxit sắt ở nhiệt độ cao. Sau khi phản ứng kết thúc thu được 25,2g sắt, làm lạnh hơi nước thu được sau phản ứng. a. tính thể tích khí H2 đã phản ứng ở đktc b. xác định CTHH của oxit sắt đó c. tính thể tích nước thu đc ở thể lỏng ( giải thích các bước làm )
a) \(n_O=\dfrac{34,8-25,2}{16}=0,6\left(mol\right)\)
=> \(n_{H_2O}=0,6\left(mol\right)\) (bảo toàn O)
=> \(n_{H_2}=0,6\left(mol\right)\) (bảo toàn H)
=> \(V_{H_2}=0,6.22,4=13,44\left(l\right)\)
b) \(n_{Fe}=\dfrac{25,2}{56}=0,45\left(mol\right)\)
nFe : nO = 0,45 : 0,6 = 3 : 4
=> CTHH: Fe3O4
c) \(m_{H_2O}=0,6.18=10,8\left(g\right)\)
Mà \(d_{H_2O}=1\left(g/ml\right)\)
=> \(V_{H_2O}=10,8\left(ml\right)\)
Đúng 2
Bình luận (0)
Dùng khí H2 để khử hoàn toàn 4,64g một oxit sắt chưa rõ công thức ở nhiệt độ cao, sau phản ứng thu được 3,36g Fe. Xác định CTHH của oxit sắt
\(m_O=4.64-3.36=1.28\left(g\right)\)
\(n_{Fe}=\dfrac{3.36}{56}=0.06\left(mol\right)\)
\(n_O=\dfrac{1.28}{16}=0.08\left(mol\right)\)
\(n_{Fe}:n_O=0.06:0.08=3:4\)
\(CT:Fe_3O_4\)
Đúng 1
Bình luận (0)
Khử 24 gam sắt III oxit bằng Hydro thu được Fe và nước.
a. Viết phương trình phản ứng xảy ra.
b. Tính thể tích khí Hydro ở đktc cần dùng.
c. Tính khối lượng sắt thu được sau phản ứng?
\(n_{Fe_2O_3=}=\dfrac{24}{160}=0,15mol\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
0,15 0,45 0,3 0,45
\(V_{H_2}=0,45\cdot224,=10,08l\)
\(m_{Fe}=0,3\cdot56=16,8g\)
Đúng 3
Bình luận (0)
Khử hoàn toàn 24,1 gam hỗn hợp A gồm kẽm oxit và một oxit sắt bằng khi hidro
dư ở nhiệt độ cao, sau phản ứng thu được 17,7 gam chất rắn B. Hòa tan chất rắn B bằng dung dịch axit clohidric dư thu được 6,72 lít khi (ở đktc). Xác định công thức phân tử của oxit sắt và tính % theo khối lượng của hỗn hợp A.
Gọi CTHH của oxit sắt là FexOy.
PT: \(ZnO+H_2\underrightarrow{t^o}Zn+H_2O\)
\(Fe_xO_y+yH_2\underrightarrow{t^o}xFe+yH_2O\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
B gồm: Zn và Fe.
Gọi: \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\) ⇒ 65a + 56b = 17,7 (1)
Theo PT: \(n_{H_2}=n_{Zn}+n_{Fe}=a+b=\dfrac{6,72}{22,4}=0,3\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,2\left(mol\right)\end{matrix}\right.\)
Theo PT: \(\left\{{}\begin{matrix}n_{ZnO}=n_{Zn}=0,1\left(mol\right)\\n_{Fe_xO_y}=\dfrac{1}{x}n_{Fe}=\dfrac{0,2}{x}\left(mol\right)\end{matrix}\right.\)
Có: mZnO + mFexOy = 24,1 ⇒ mFexOy = 24,1 - 0,1.81 = 16 (g)
\(\Rightarrow M_{Fe_xO_y}=\dfrac{16}{\dfrac{0,2}{x}}=80x\left(g/mol\right)\)
\(\Rightarrow56x+16y=80x\Rightarrow\dfrac{x}{y}=\dfrac{2}{3}\)
Vậy: CTHH cần tìm là Fe2O3.
\(\Rightarrow\left\{{}\begin{matrix}\%m_{ZnO}=\dfrac{0,1.81}{24,1}.100\%\approx33,61\%\\\%m_{Fe_2O_3}\approx66,39\%\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Khử hoàn toàn 11.6 (g) một oxit kim loại R bằng khí CO dư ở nhiệt độ cao. Kết thúc phản ứng thu được kim loại R và 11.2 lít hỗn hợp khí A nặng 17.2 (g). Hòa tan hết lượng kim loại thu được ở trên bằng dung dịch H2SO4 10% vừa đủ, thu được 3.36 lít khí H2 thoát ra và dung dịch B. Biết các thể tích khí đều ở đktca) Xác định công thức oxitb) Tính C% của dd Bc) Thể tích CO đã dùng ở đktc
Đọc tiếp
Khử hoàn toàn 11.6 (g) một oxit kim loại R bằng khí CO dư ở nhiệt độ cao. Kết thúc phản ứng thu được kim loại R và 11.2 lít hỗn hợp khí A nặng 17.2 (g). Hòa tan hết lượng kim loại thu được ở trên bằng dung dịch H2SO4 10% vừa đủ, thu được 3.36 lít khí H2 thoát ra và dung dịch B. Biết các thể tích khí đều ở đktc
a) Xác định công thức oxit
b) Tính C% của dd B
c) Thể tích CO đã dùng ở đktc
n hh khí = 0.5 mol
nCO: x mol
nCO2: y mol
=> x + y = 0.5
28x + 44y = 17.2 g
=> x = 0.3 mol
y = 0.2 mol
Khối lượng oxi tham gia pứ oxh khử oxit KL: 0.2 * 16 = 3.2g => m KL = 11.6 - 3.2 = 8.4g
TH: KL hóa trị I => nKL = 2*nH2 = 0.3 mol => KL: 28!!
KL hóa trị III => nKL = 2/3 *nH2 = 0.1 mol => KL: 84!!
KL hóa trị II => nKL = nH2 = 0.15 mol => KL: 56 => Fe.
nFe / Oxit = 0.15 mol
nO/Oxit = 0.2 mol
=> nFe/nO = 3/4 => Fe3O4
Fe3O4 + 4CO = 3Fe + 4CO2
Fe + H2SO4 = FeSO4 + H2
0.15.....0.15.......0.15.....0.15
=> mH2SO4 pứ = 14.7 g => mdd = 147 g
m dd sau khi cho KL vào = m KL + m dd - mH2 thoát ra = 0.15 * 56 + 147 - 0.15*2 = 155.1g
=> C% FeSO4 = 14.7%
Đúng 0
Bình luận (0)
Khử hoàn toàn Sắt(III)Oxit bằng khí Hidro ở nhiệt độ cao thu được kim loại và 10,8 g nước.
a. Tính thể tích khí Hidro cần dùng ở Đktc?
b. Tính khối lượng kim loại sau phản ứng?
Tính khối lượng Sắt(III)Oxit cần dùng?
Fe2O3+3H2-to>2Fe+3H2O
0,2----------0,6------0,4-----0,6 mol
n H2O=\(\dfrac{10,8}{18}\)=0,6 mol
=>VH2=0,6.22,4=13,44l
b)m Fe=0,4.56=22,4g
c) m Fe2O3=0,2.160=32g
Đúng 2
Bình luận (0)
Khử 9,6g hỗn hợp gồm Fe2O3 và FeO bằng H2 ở nhiệt độ cao người ta thử được Fe và 2,88 H2O.
a) viết PTHH xảy ra
b)xác định thành phần % của 2 oxit trọng hỗn hợp
c) tính thể tích H2 ở dktc cần dùng để khử hết lượng oxit trên
PTHH Fe2O3+3H2−−−>2Fe+3H2O
_________x____________________3x
FeO+H2−−−>Fe+H2O
___y_____________________y
Gọi x, y lần lượt là số mol Fe2O3 và FeO
Ta có 160x+72y = 9,6
3x+y = 0,16
Đúng 1
Bình luận (0)
Khử hoàn toàn một oxit sắt X ở nhiệt độ cao cần vừa đủ V lít khí CO (ở đktc), sau phản ứng thu được 1,12 gam Fe và 0,03 mol khí CO2. Công thức của X và giá trị V lần lượt là A. Fe3O4 và 0,224 B. Fe2O3 và 0,672 C. Fe3O4 và 0,448 D. FeO và 0,224
Đọc tiếp
Khử hoàn toàn một oxit sắt X ở nhiệt độ cao cần vừa đủ V lít khí CO (ở đktc), sau phản ứng thu được 1,12 gam Fe và 0,03 mol khí CO2. Công thức của X và giá trị V lần lượt là
A. Fe3O4 và 0,224
B. Fe2O3 và 0,672
C. Fe3O4 và 0,448
D. FeO và 0,224
Đáp án B.
Đặt công thức oxit sắt là FexOy
Ta có: nFe= 1,12/56= 0,02mol
FexOy+ yCO → xFe+ yCO2
Theo PTHH:
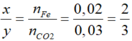
→ Oxit là Fe2O3
Ta có: nCO= nCO2= 0,03 mol→ V= 0,03.22,4= 0,672 lít
Đúng 0
Bình luận (0)























