a) Hợp chất D biết 0,2 mol hợp chất D có chứa 9,2 g Na, 2,4g C và 9,6g O

Những câu hỏi liên quan
Lập CTHH của hợp chất D biết: 0,2 mol hợp chất D có chứa 9,2g Na; 2,4g C và 9,6g O
\(m_{D}=9,2+2,4+9,6=21,2(g)\\ M_D=\frac{21,2}{0,2}=106(g/mol)\\ Na_xC_xO_y\\ x:y:z=\frac{9,2}{23} : \frac{2,4}{12} : \frac{9,6}{16}\\ x:y:z=0,4 : 0,2 : 0,6\\ x:y:z=2:1:3\\ CTDGN: (Na_2CO_3)_n=106\\ (106).n=106\\ n=1 \to Na_2CO_3\)
Đúng 4
Bình luận (0)
Lập cthh của hợp chất D biết 0,2 mol hợp chất D chứa 9,2g Na, 2,4g C và 9,6g O
m = 9,2 + 2,4 + 9,6 = 21,2 g ---> M = 21,2/0,2 = 106 đvC.
D: NaxCyOz ---> 23x:12y:16z = 9,2:2,4:9,6 ---> x:y:z = 0,4:0,2:0,6 = 2:1:3 ---> D: (Na2CO3)n.
---> 106n = 106 ---> n = 1 ---> D: Na2CO3.
Đúng 0
Bình luận (1)
Lập CTHH hợp chất
1.Hợp chất B (hc khí) biết tỉ lệ về khối lượng các nguyên tố tạo thành : mC:mH=6:1,1 lít khí B nặng 1,25g (đktc)
2.Hợp chất C,biết tỉ lệ về khối lượng các nguyên tố là: mCa:mN:mO=10:7:24 và 0,2 mol hợp chất C nặng 32,8g
3.Hợp chất D biết 0,2 mol hợp chất D chứa 9,2g Na;2,4g C;9,6g O
Xin cảm ơn.
1.
\(M_B=1,25.22,4=28\)
\(m_C:m_H=6:1\)
=>\(n_C:n_H=\frac{6}{12}:\frac{1}{1}=0,5:1=1:2\)
=> CTHH:C2H4
2
\(m_{Ca}:m_N:m_O=10:7:24\)
\(\Rightarrow n_{Ca}:n_N:n_O=\frac{10}{12}:\frac{7}{14}:\frac{24}{16}=0,833:0,5:1,5\)=\(1:2:6\)
\(M_C=\frac{32,8}{0,2}=164\)
=>CTHH:Ca(NO3)2
3
Do hợp chất có 0,2 g
=>\(m_{Na}=9,2.2=18,4\left(g\right)\)
\(m_C=2,4.2=4,8\left(g\right)\)
\(m_{O2}=9,6.2=18,4\)
\(n_{Na}:n_C:n_O=\frac{18,4}{23}:\frac{4,8}{12}:\frac{19,2}{16}=0,8:0,4:1,2=2:1:3\)
CTHH:Na2CO3
Cho biết thành phần theo khối lượng của một số hợp chất, hãy tìm công thức hóa học của chúng: - Hợp chất A: 0,2 mol hợp chất có chứa 4,6g Na và 7,1g Cl. - Hợp chất B: 0,03 mol hợp chất có chứa 0,36g C và 0,96g O. - Hợp chất C: 0,02 mol hợp chất có chứa 4,14g Pb và 0,32g O. - Hợp chất D: 0,04 mol hợp chất có chứa 0,08 mol nguyên tử Fe và 0,12 mol nguyên tử O. - Hợp chất E: 0,02 mol hợp chất có 0,04 mol nguyên tử Na, 0,02mol nguyên tử C và 0,06 mol nguyên tử O.
Đọc tiếp
Cho biết thành phần theo khối lượng của một số hợp chất, hãy tìm công thức hóa học của chúng:
- Hợp chất A: 0,2 mol hợp chất có chứa 4,6g Na và 7,1g Cl.
- Hợp chất B: 0,03 mol hợp chất có chứa 0,36g C và 0,96g O.
- Hợp chất C: 0,02 mol hợp chất có chứa 4,14g Pb và 0,32g O.
- Hợp chất D: 0,04 mol hợp chất có chứa 0,08 mol nguyên tử Fe và 0,12 mol nguyên tử O.
- Hợp chất E: 0,02 mol hợp chất có 0,04 mol nguyên tử Na, 0,02mol nguyên tử C và 0,06 mol nguyên tử O.
- Hợp chất A:
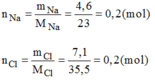
Cứ 0,2 mol hợp chất A có chứa 0,2 mol Na và 0,2 mol Cl.
Suy ra 1 mol hợp chất A có chứa 1 mol Na và 1 mol Cl.
Vậy công thức hóa học đơn giản của A là NaCl.
- Hợp chất B:
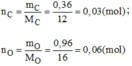
Vậy 0,03mol phân tử B có chứa 0,03 mol phân tử C và 0,06 mol nguyên tử O.
Suy ra 1 mol phân tử B có chứa 1 mol nguyên tử C và 2 mol nguyên tử O.
→Công thức hóa học của B là C O 2
- Hợp chất C:
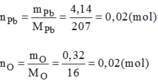
Vậy 0,02 mol phân tử C có chứa 0,02 mol nguyên tử Pb và 0,02 mol nguyên tử O.
Suy ra 1 mol phân tử C có chứa 1 mol nguyên tử Pb và 1 mol nguyên tử O.
→Công thức của phân tử C là: PbO.
- Hợp chất D:
Theo đề bài: 0,04 mol phân tử D có 0,08 mol Fe và 3 mol O.
Vậy 1 mol phân tử D có: 2 mol Fe và 0,12 mol O.
→ Công thức hóa học của D là F e 2 O 3
- Hợp chất E:
Cho biết: 0,02 mol phân tử E có 0,04 mol Na kết hợp 0,02 mol C và 0,06 mol nguyên tử O.
Vậy 1 mol phân tử E co 2 mol Na kết hợp 1 mol C và 3 mol O.
Công thức hóa học của E là N a 2 C O 3 .
Đúng 0
Bình luận (0)
1. Hãy xác định cong thức các hợp chất sau:
a, Hợp chất A biết: thành phần % về khối lượng các nguyên tố là 40% Cu, 20%S và 40%O trong phân tử hợp chất có 1 nguyên tử S
b, Hợp chất B( hợp chất khí ) biết tỉ lệ về khối lượng các nguyên tố tạo thành: mO: mH6:1, một lít khí B (đktc) nặng 1n25g
c, Hợp chất C biết tỉ lệ về khối lượng các nguyên tố là mCa:mN:mo10:7:24 và 0,2 mol hợp chất C nặng 32,8gam
d, Hợp chất D biết 0,2 mol hợp chất D có chứa 9,2g Na, 2,4g C và 9,6g O
Đọc tiếp
1. Hãy xác định cong thức các hợp chất sau:
a, Hợp chất A biết: thành phần % về khối lượng các nguyên tố là 40% Cu, 20%S và 40%O trong phân tử hợp chất có 1 nguyên tử S
b, Hợp chất B( hợp chất khí ) biết tỉ lệ về khối lượng các nguyên tố tạo thành: \(mO: mH=6:1\), một lít khí B (đktc) nặng 1n25g
c, Hợp chất C biết tỉ lệ về khối lượng các nguyên tố là \(mCa:mN:mo=10:7:24\) và 0,2 mol hợp chất C nặng 32,8gam
d, Hợp chất D biết 0,2 mol hợp chất D có chứa 9,2g Na, 2,4g C và 9,6g O
a, Gọi CTHH của hợp chất là CuxSyOz
Ta có x:y:z = \(\dfrac{40}{64}:\dfrac{20}{32}:\dfrac{40}{16}\)= 0,625:0,625:2,5
= 1:1:4
Suy ra CTHH của hợp chất A là CuSO4
Đúng 1
Bình luận (0)
c, Ta có MC = \(\dfrac{32,8}{0,2}\)= 164(g/mol)
Gọi CTHH của hợp chất C là CaxNyOz
x:y:z = \(\dfrac{10}{40}:\dfrac{7}{14}:\dfrac{24}{16}\)= 0,25:0,5:1,5
= 1:2:6
=> CT đơn giản của h/c là CaN2O6 hay Ca(NO3)2
Ta có : (CaN2O6)n = 164
=> n = 1
Vậy CTHH của h/c C là Ca(NO3)2
Đúng 1
Bình luận (0)
cho biết thành phần theo khối lượng của một số hợp chất, hãy tìm công thức hóa học của chúng.-hợp chất A: 0,2 mol hợp chất có chứa 4,6g Na và 7,1g Cl. -hợp chất B: 0,03 mol hợp chất có chứa 0,36g C và 0,96g O. -hợp chất C: 0,02 mol hợp chất có chứa 4,14g Pb và 0,32g O. -hợp chất D: 0,04 mol hợp chất có chứa 0,08 mol nguyên tử Fe và 0,12 mol nguyên tử O.-hợp chất E: 0,02 mol hợp chất có chứa 0,04 mol nguyên tử Na và 0,12 mol nguyên tử C và 0,06 mol nguyên tử O.
Đọc tiếp
cho biết thành phần theo khối lượng của một số hợp chất, hãy tìm công thức hóa học của chúng.
-hợp chất A: 0,2 mol hợp chất có chứa 4,6g Na và 7,1g Cl.
-hợp chất B: 0,03 mol hợp chất có chứa 0,36g C và 0,96g O.
-hợp chất C: 0,02 mol hợp chất có chứa 4,14g Pb và 0,32g O.
-hợp chất D: 0,04 mol hợp chất có chứa 0,08 mol nguyên tử Fe và 0,12 mol nguyên tử O.
-hợp chất E: 0,02 mol hợp chất có chứa 0,04 mol nguyên tử Na và 0,12 mol nguyên tử C và 0,06 mol nguyên tử O.
Hợp chất A
\(n_{Na}=\dfrac{4,6}{23}=0,2mol\\ n_{Cl}=\dfrac{7,1}{35,5}=0,2mol\)
Na + Cl \(\rightarrow\) A
0,2 0,2 0,2 ( mol ) \(\left\{Phần.này.bạn.không.hiểu.thì.hỏi.mình.nhé!\right\}\)
\(\Rightarrow\) 1 1 1 ( mol )
\(\Rightarrow CTHH:NaCl\)
< Mấy cái ở dưới cũng làm tương tự >
Đúng 4
Bình luận (0)
Tìm CTHH
a) 40% Cu, 20% S, 40% O. Biết trong phân tử có 1 nguyên tử S
b hợp chất A biết :
0,2 mol A có : 9,2(g) Na
: 9,6 (g) O
: 21 (g) O
1. Ta có:
%mO=100%−40%−20%=40%%mO=100%−40%−20%=40%
Đặt CTHH của hợp chất là CuxSyOz
Ta có tỉ lệ:
x:y:z=40/64 : 20/32 : 40/16
= 0,6 : 0,6 : 2,5
= 1 : 1 : 4
=> CTHH đơn giản của hợp chất là (CuSO4)n
Vì 1 mol của Cu chính là 1 nguyên tử Cu => n = 1
Vậy CTHH của hợp chất là CuSO4
Đúng 0
Bình luận (0)
Bài 1: Hãy xây dựng công thức các hợp chất sau:
a. Hợp chất A biết: thành phần % về khối lượng các nguyên tố là 40% Cu, 20% S và 40% O trong phân tử hợp chất có 1 nguyên tử S
b. Hợp chất B ( chất khí) biết tỉ lệ về khối lượng các nguyên tố tạo thành : mC : mH 6 : 1, 1 lít khí B ( đktc ) nặng 1,52g.
c. Hợp chất C, biết tỉ lệ về khối lượng các nguyên tố là mCa : mN : mO 10 : 7 : 24 và 0,2 mol hợp chất C nặng 32,8g.
d. Hợp chất D biết: 0,2 mol hợp chất D có chứa: 9,2g Na; 2,4g C và 9,6...
Đọc tiếp
Bài 1: Hãy xây dựng công thức các hợp chất sau:
a. Hợp chất A biết: thành phần % về khối lượng các nguyên tố là 40% Cu, 20% S và 40% O trong phân tử hợp chất có 1 nguyên tử S
b. Hợp chất B ( chất khí) biết tỉ lệ về khối lượng các nguyên tố tạo thành : mC : mH = 6 : 1, 1 lít khí B ( đktc ) nặng 1,52g.
c. Hợp chất C, biết tỉ lệ về khối lượng các nguyên tố là mCa : mN : mO = 10 : 7 : 24 và 0,2 mol hợp chất C nặng 32,8g.
d. Hợp chất D biết: 0,2 mol hợp chất D có chứa: 9,2g Na; 2,4g C và 9,6g O.
Bài 2: Đốt cháy 2,7g Al trong không khí thu đc 2,65g Al2O. Tính khối lượng các chất rắn còn lại sau phản ứng
Bài 3: Cho 6,4g Cu phản ứng hoàn toàn vs 3,36 lít O2 thu đc CuO.
a. Tính khối lượng CuO thu đc sau phản ứng
b. Tính khối lượng chất dư sau phản ứng
Mọi người giúp e ạ!!
Bài 3: Giải:
Ta có:
\(n_{Cu}=\frac{6,4}{64}=0,1\left(mol\right);\\ n_{O_2}=\frac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: 2Cu + O2 -> 2CuO
a) Theo PTHH và đề bài, ta có:
\(\frac{0,1}{2}=0,05< \frac{0,15}{1}=0,15\)
=> Cu hết, O2 dư nên tinh theo nCu
Theo PTHH và đề bài, ta có:
\(n_{CuO}=n_{Cu}=0,1\left(mol\right)\)
Khối lượng CuO thu được sau phản ứng:
\(m_{CuO}=0,1.80=8\left(g\right)\)
b) Theo PTHH và đề bài, ta có:
\(n_{O_2\left(phảnứng\right)}=\frac{n_{Cu}}{2}=\frac{0,1}{2}=0,05\left(mol\right)\)
=> \(n_{O_2\left(dư\right)}=0,15-0,05=0,1\left(mol\right)\)
Khối lượng O2 dư:
\(m_{O_2\left(dư\right)}=0,1.32=3,2\left(g\right)\)
Đúng 0
Bình luận (0)
Bài 2:
PTHH: 4Al+3O2->2Al2O3
mol 4----3------2
nAl=\(\frac{2,7}{27}\)=0.1 mol ; nAl2O3=\(\frac{2,65}{102}\)≈0.026 mol
Ta có: nAl>2.nAl2O3
⇒Al dư
nAldư=nAlbanđau-nAlpư=0,1-2.0,026=0,048 mol
⇒⇒mAldư=0,048.27=1,296 g
Khối lượng các chất rắn còn lại sau phản ứng là:
mAldư+mAl2O3=1,296+2,65=3,946g
Đúng 0
Bình luận (0)
1. Lập công thức hóa học hợp chất B (hợp chất khí) biết tỉ lệ khối lượng các nguyên tố tạo thành: mC :mH 6:1, một lít khí B (đktc) nặng 1,25g
2. Lập công thức hóa học hợp chất D biết: 0,2 mol hợp chất D có chứa 9,2g Na; 2,4g C và 9,6 O
3. Phân tử khối của đồng sunfat là 160 đvC. Trong đó có một nguyên tử Cu có nguyên tử khối là 64, một nguyên tử S có nguyên tử khối là 32, còn lại là nguyên tử oxi. Công thức phân của hợp chất là như thế nào?
Đọc tiếp
1. Lập công thức hóa học hợp chất B (hợp chất khí) biết tỉ lệ khối lượng các nguyên tố tạo thành: mC :mH =6:1, một lít khí B (đktc) nặng 1,25g
2. Lập công thức hóa học hợp chất D biết: 0,2 mol hợp chất D có chứa 9,2g Na; 2,4g C và 9,6 O
3. Phân tử khối của đồng sunfat là 160 đvC. Trong đó có một nguyên tử Cu có nguyên tử khối là 64, một nguyên tử S có nguyên tử khối là 32, còn lại là nguyên tử oxi. Công thức phân của hợp chất là như thế nào?
Bài 2:
Ta có:
| Nguyên tố | 0,2 mol hợp chất D | 1 mol hợp chất D |
| Na | 9,2(g) | 9,2.5=46(g) |
| C | 2,4(g) | 2,4.5=12(g) |
| O | 9,6(g) | 9,6.5=48(g) |
Trong 1 mol hợp chất D có chứa:
\(n_{Na}=\frac{46}{23}=2\left(mol\right);\\ n_C=\frac{12}{12}=1\left(mol\right);\\ n_O=\frac{48}{16}=3\left(mol\right)\)
Vậy: Hợp chất D nói trên có CTHH là Na2CO3 ( đọc là: natri cacbonat).
Đúng 0
Bình luận (1)
Bài 3:
Trong hợp chất cần tìm , khối lượng O bằng:
\(m_O=m_{hợpchất}-m_{Cu}-m_S\\ =160-64-32=64\left(đ.v.C\right)\)
Ta được:
\(n_{Cu}=\frac{64}{64}=1\left(mol\right);\\ n_S=\frac{32}{32}=1\left(mol\right);n_O=\frac{64}{16}=4\left(mol\right)\)
Vậy: CTHH của hợp chất cần tìm là CuSO4 (đọc là: Đồng (II) sunfat).
Đúng 0
Bình luận (0)
Bài 1 :
CTHH dạng TQ là CxHy
nCxHy = V/22.4 = 1/22.4 = 5/112 (mol)
=> MCxHy = m/n = 1.25 : 5/112 = 28 (g)
Ta có mC : mH = 6 : 1
=> nC / nH . MC/ MH = 6 :1
=> nC / nH . 12 =6
=> nC/ nH = 1/2 hay x: y = 1 : 2
=> x = 1 và y =2
=> CTHH tối giản :CH2
=> CTHH thực nghiệm : (CH2 )n = 28
=> 14n =28
=> n = 2
=> CTHH của chất B là C2H4
Đúng 0
Bình luận (0)
























