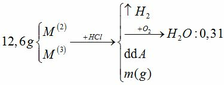
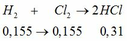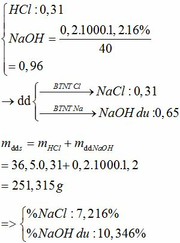Đốt cháy hoàn toàn 13,44 gam một muối sunfat của kim loại M hóa trị II , bằng lượng oxi vừa đủ thu được chất rắn A và khí B . Hòa tan A bằng dung dịch H2SO4 13,720% ( vừa đủ ) thu được dung dịch muối nồng độ 20,144% làm lạnh dung dịch này đến toC thấy tách ra được 12,50 gam tinh thể T , phần dung dịch bão hòa có nồng độ 14,589%
a) Xác định kim loại M và công thức của tinh thể T . Biết trong các phản ứng trên M có hóa trị không đổi
b) Tính độ tan của muối trong dung dịch bão hòa ở toC