giải hộ em hâi bài khó quá
1 cùng một lượng chát R khi lần lượt hòa tang hết bằng dd HCI và H2SO4 đặc nóng thì khối lượng SO2 sinh ra gấp 48 lần H@ mặt khác khối lượng muối clỏua bằng 63,5% khối lượng mối sùnat. kim loaại R llà A.Al B.Mg .C Zn d,Fe
2có một loại quặng pỉrit chứa 96% fes2 nêu ỗi ngày muốn sản suất 100 tấn H2SO4 98% tì lượng quặng trên dùng là bao nhiêu ? biết hiệu suất của H2SO4 là 90% A 70,44 tấn B69.44 c 67,44 d68.44

Những câu hỏi liên quan
Cùng một lượng R khi hòa tan hết bằng dd hcl h2so4 đ,n thì lượng SO2 gấp 48 lần H2 sinh ra . mặt khác khối lượng muối clorua bằng 63,5% khối lượng muối sunphat . R là
Cùng một lượng R khi hòa tan hết bằng dd HCl và H2So4 đ,n thì lượng SO2 gấp 8 lần lượng H2 sinh ra Mặt khác khối lượng muối Clorua bằng 63,5 % khối lượng muối sunfat. R?
Hoà tan cùng một lượng kim loại R vào dung dịch HNO3 đặc nóng và vào dung dịch H2SO4 loãng thì thể tích NO2 thu được bằng 3 lần thể tích H2 cùng điều kiện, khối lượng muối sunfat bằng 62,81% khối lượng muối nitrat tạo thành. Mặt khác khi nung cùng một lượng kim loại R như trên thì cần thể tích O2 bằng 22,22% thể tích NO2 ở trên cùng điều kiện thu được chất rắn A. Hoà tan 20,88 gam A vào dung dịch HNO3 20% (lấy dư 25% so vói lượng cần thiết) thu được 0,672 lít khí B (dktc) là một oxit của nitơ Nx...
Đọc tiếp
Hoà tan cùng một lượng kim loại R vào dung dịch HNO3 đặc nóng và vào dung dịch H2SO4 loãng thì thể tích NO2 thu được bằng 3 lần thể tích H2 cùng điều kiện, khối lượng muối sunfat bằng 62,81% khối lượng muối nitrat tạo thành. Mặt khác khi nung cùng một lượng kim loại R như trên thì cần thể tích O2 bằng 22,22% thể tích NO2 ở trên cùng điều kiện thu được chất rắn A. Hoà tan 20,88 gam A vào dung dịch HNO3 20% (lấy dư 25% so vói lượng cần thiết) thu được 0,672 lít khí B (dktc) là một oxit của nitơ NxOy. Khối lượng dung dịch HNO3 đã sử dụng là:
A. 66,15 gam
B. 264,6 gam
C. 330,75 gam
D. 266,4 gam
Đáp án C
Áp dụng định luật bảo toàn mol electron, ta có:
Mà n N O 2 = 3 n H 2 n ê n n e n h ư ờ n g ( 1 ) = n N O 2 n e n h ư ờ n g ( 2 ) = 2 n H 2
Nên ne nhường(1) =3/2 ne nhường(2)
Do đó số mol electron trao đổi ở hai trường hợp là không giống nhau nên R là kim loại có nhiều hóa trị.
Mà kim loại có hóa trị I, II hoặc III.
Kết hợp với
n e n h ư ờ n g ( 1 ) n e n h ư ờ n g ( 2 ) = n R . h o a t r i 1 n p . h o a t r i 2 = 3 2
Ta được R có hóa trị II và III (trong đó R thể hiện hóa trị II khi tác dụng với dung dịch H2SO4 loãng và thể hiện hóa trị III khi tác dụng với dung dịch HNO3 đặc nóng).
Chọn 3 mol R đem hòa tan ban đầu. Khi đó ở các lần thí nghiệm ta thu được 3 mol R(NO3)3 và 3 mol RSO4.
Theo giả thiết ta có:
m R S O 4 = 62 , 81 % m R ( N O 3 ) 2
hay R + 96 = 62,81%(R +186)ÛR = 56ÞR là Fe.
Khi đó, áp dụng định luật bảo toàn moi electron ta có số mol NO2 tạo thành là: n NO2= 3nFe=9
Khi đó lượng oxi đã sử dụng là 9.22,22% = 2
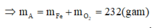
A sẽ chứa một hoặc một số oxit của Fe. Để đơn giản cho quá trình tính toán, coi A là hỗn hợp chứa 3 mol Fe và 4 mol O.
Khi đó trong 20,88 gam A (20,88 = 0,09.232) có 0,27 mol Fe và 0,36 mol O.
nB = 0,03.
Gọi n là số mol electron mà x mol nguyên tử nhận để thu được 1 mol NxOy
Áp dụng định luật bảo toàn mol electron, ta có:
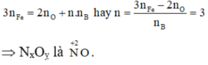
Khi đó:
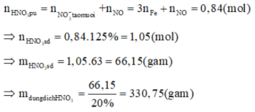
Đúng 0
Bình luận (0)
Hoà tan cùng một lượng kim loại R vào dung dịch HNO3 đặc nóng và vào dung dịch H2SO4 loãng thì thể tích NO2 thu được bằng 3 lần thể tích H2 cùng điều kiện, khối lượng muối sunfat bằng 62,81% khối lượng muối nitrat tạo thành. Mặt khác khi nung cùng một lượng kim loại R như trên thì cần thể tích O2 bằng 22,22% thể tích NO2 ở trên cùng điều kiện thu được chất rắn A. Hoà tan 20,88 gam A vào dung dịch HNO3 20% (lấy dư 25% so vói lượng cần thiết) thu được 0,672 lít khí B (dktc) là một oxit của nitơ Nx...
Đọc tiếp
Hoà tan cùng một lượng kim loại R vào dung dịch HNO3 đặc nóng và vào dung dịch H2SO4 loãng thì thể tích NO2 thu được bằng 3 lần thể tích H2 cùng điều kiện, khối lượng muối sunfat bằng 62,81% khối lượng muối nitrat tạo thành. Mặt khác khi nung cùng một lượng kim loại R như trên thì cần thể tích O2 bằng 22,22% thể tích NO2 ở trên cùng điều kiện thu được chất rắn A. Hoà tan 20,88 gam A vào dung dịch HNO3 20% (lấy dư 25% so vói lượng cần thiết) thu được 0,672 lít khí B (dktc) là một oxit của nitơ NxOy. Khối lượng dung dịch HNO3 đã sử dụng là:
A. 66,15 gam
B. 264,6 gam
C. 330,75 gam
D. 266,4 gam
Đáp án C
Áp dụng định luật bảo toàn mol electron, ta có:
Mà nên
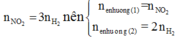
Nên ne nhường(1) = ne nhường(2)
Do đó số mol electron trao đổi ở hai trường hợp là không giống nhau nên R là kim loại có nhiều hóa trị.
Mà kim loại có hóa trị I, II hoặc III.
Kết hợp với
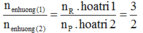
Ta được R có hóa trị II và III (trong đó R thể hiện hóa trị II khi tác dụng với dung dịch H2SO4 loãng và thể hiện hóa trị III khi tác dụng với dung dịch HNO3 đặc nóng).
Chọn 3 mol R đem hòa tan ban đầu. Khi đó ở các lần thí nghiệm ta thu được 3 mol R(NO3)3 và 3 mol RSO4.
Theo giả thiết ta có:
![]()
hay R + 96 = 62,81%(R +186)ÛR = 56ÞR là Fe.
Khi đó, áp dụng định luật bảo toàn moi electron ta có số mol NO2 tạo thành là:
![]()
Khi đó lượng oxi đã sử dụng là 9.22,22% = 2
![]()
A sẽ chứa một hoặc một số oxit của Fe. Để đơn giản cho quá trình tính toán, coi A là hỗn hợp chứa 3 mol Fe và 4 mol O.
Khi đó trong 20,88 gam A (20,88 = 0,09.232) có 0,27 mol Fe và 0,36 mol O.
nB = 0,03.
Gọi n là số mol electron mà x mol nguyên tử N + 5 nhận để thu được 1 mol NxOy
Áp dụng định luật bảo toàn mol electron, ta có:

Þ NxOỵ là .
Khi đó
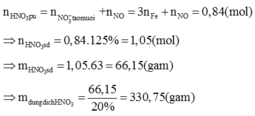
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 49,6 gam hỗn hợp X gồm Fe, FeO, Fe2O3 và Fe3O4 bằng H2SO4 đặc, nóng thu được dung dịch Y và 8,96 lít khí SO2 (đktc). Thành phần phần trăm về khối lượng của oxi trong hỗn hợp X và khối lượng muối trong dung dịch Y lần lượt là
Coi X gồm Fe và O.
Ta có: 56nFe + 16nO = 49,6 (1)
\(n_{SO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
BT e, có: 3nFe - 2nO = 2nSO2 = 0,8 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=0,7\left(mol\right)\\n_O=0,65\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\%m_O=\dfrac{0,65.16}{49,6}.100\%\approx20,97\%\)
Muối thu được là Fe2(SO4)3
BTNT Fe, có: \(n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Fe}=0,35\left(mol\right)\)
\(\Rightarrow m_{Fe_2\left(SO_4\right)_3}=0,35.400=140\left(g\right)\)
Đúng 4
Bình luận (0)
Hòa tan hoàn toàn y gam một oxit sắt bằng H2SO4 đặc, nóng thấy thoát ra khí SO2 duy nhất. Trong thí nghiệm khác, sau khi khử hoàn toàn cũng y gam oxit đó bằng CO ở nhiệt độ cao rồi hòa tan lượng sắt tạo thành bằng H2SO4 đặc, nóng thì thu được lượng khí SO2 nhiều gấp 9 lần lượng khí SO2 ờ thí nghiệm trên. Công thức của oxit sắt là A. FeO. B. Fe2O3 C. Fe3O4 D. FeCO3.
Đọc tiếp
Hòa tan hoàn toàn y gam một oxit sắt bằng H2SO4 đặc, nóng thấy thoát ra khí SO2 duy nhất. Trong thí nghiệm khác, sau khi khử hoàn toàn cũng y gam oxit đó bằng CO ở nhiệt độ cao rồi hòa tan lượng sắt tạo thành bằng H2SO4 đặc, nóng thì thu được lượng khí SO2 nhiều gấp 9 lần lượng khí SO2 ờ thí nghiệm trên. Công thức của oxit sắt là
A. FeO.
B. Fe2O3
C. Fe3O4
D. FeCO3.
Đáp án C
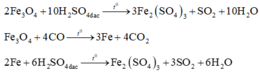
Coi oxit sắt ban đầu là hỗn hợp gồm Fe và O với nFe = a và nO = b.

Với lần thí nghiệm thứ nhất, có sự tham gia của O. Áp dụng định luật bảo toàn mol electron, ta có:
![]()
Với lần thí nghiệm thứ hai, không có sự tham gia của O. Áp dụng định luật bảo toàn mol
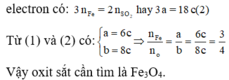
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn y gam một oxit sắt bằng H2SO4 đặc, nóng thấy thoát ra khí SO2 duy nhất. Trong thí nghiệm khác, sau khi khử hoàn toàn cũng y gam oxit đó bằng CO ở nhiệt độ cao rồi hòa tan lượng sắt tạo thành bằng H2SO4 đặc, nóng thì thu được lượng khí SO2 nhiều gấp 9 lần lượng khí SO2 ờ thí nghiệm trên. Công thức của oxit sắt là: A. FeO. B. Fe2O3 C. Fe3O4 D. FeCO3.
Đọc tiếp
Hòa tan hoàn toàn y gam một oxit sắt bằng H2SO4 đặc, nóng thấy thoát ra khí SO2 duy nhất. Trong thí nghiệm khác, sau khi khử hoàn toàn cũng y gam oxit đó bằng CO ở nhiệt độ cao rồi hòa tan lượng sắt tạo thành bằng H2SO4 đặc, nóng thì thu được lượng khí SO2 nhiều gấp 9 lần lượng khí SO2 ờ thí nghiệm trên. Công thức của oxit sắt là:
A. FeO.
B. Fe2O3
C. Fe3O4
D. FeCO3.
Đáp án C
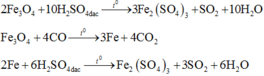
Coi oxit sắt ban đầu là hỗn hợp gồm Fe và O với nFe = a và nO = b.
Gọi thì ![]()
Các quá trình nhường và nhận electron diễn ra như sau:
Quá trình nhường electron:


Đúng 0
Bình luận (0)
Khi cho cùng một lượng kim loại M vào dung dịch HNO3 đặc nóng dư và dung dịch H2SO4 loãng dư, phản ứng hoàn toàn thì thể tích khí NO2 (sản phẩm khử duy nhất) thu được gấp 3 lần thể tích khí H2 ở cùng điều kiện nhiệt độ và áp suất. Khối lượng muối sunfat thu được bằng 62,81% khối lượng muối nitrat tạo thành. Xác định kim loại M? A. Zn B. Fe C. Mg D. Ca
Đọc tiếp
Khi cho cùng một lượng kim loại M vào dung dịch HNO3 đặc nóng dư và dung dịch H2SO4 loãng dư, phản ứng hoàn toàn thì thể tích khí NO2 (sản phẩm khử duy nhất) thu được gấp 3 lần thể tích khí H2 ở cùng điều kiện nhiệt độ và áp suất. Khối lượng muối sunfat thu được bằng 62,81% khối lượng muối nitrat tạo thành. Xác định kim loại M?
A. Zn
B. Fe
C. Mg
D. Ca
Gọi n, m là hóa trị của R khi tác dụng HNO3 và H2SO4 loãng ( 1≤ m≤ n≤ 3)
Chọn nR= 1 mol
2R + mH2SO4 →R2(SO4)m + mH2↑
1 → 0,5 0,5m
R + 2nHNO3 →R(NO3)n + nNO2 + nH2O
1 1 n
Ta có: n=3.0,5m n=1,5m m=2, n=3 là phù hợp.
Ta có: (R + 96)=(R + 186). 0,6281 R=56 R là Fe.
Đáp án B
Đúng 0
Bình luận (0)
Khi hòa tan cùng một lượng kim loại R trong dd HNO3 đặc nóng và trong dd H2SO4 loãng thì thể tích khia NO2 thu được gấp 3 lần thể tích H2 cùng điều kiện khối lượng muối sunfat thu được bằng 62,8% khối lượng muối nitrat thu được. Xác định R
Giả sử nNO2 = 3 mol và nH2 = 1 mol
TN1: Tác dụng với HNO3 đặc nóng
\(\text{n e = nNO2 = 3 mol}\)
Mà \(\text{nNO3-(muối KL) = n e = nNO2 = 3 mol}\)
\(\rightarrow\)m muối nitrat = mR + mNO3- = mR + 3.62 = mR + 186 (g)
TN2: Tác dụng với H2SO4 loãng
\(\text{n e = 2nH2 = 2 mol}\)
Mà \(\text{nSO4 2-(muối KL) = 0,5.n e = 1 mol}\)
=> m muối sunfat = mR + mSO4 2- = \(\text{mR + 1.96 = mR + 96 (g)}\)
Mà khối lượng muối sunfat bằng 62,8% khối lượng muối nitrat nên ta có:
\(m_R+96=\frac{62,8}{100}\left(mR+186\right)\rightarrow m_R=56\)
Giả sử hóa trị cao nhất của KL là n. Xét thí nghiệm 1:
Áp dụng bảo toàn e: n.nR = nNO2 → n.nR = 3 → nR = 3/n (mol)
→ MR = mR : nR = 56 : \(\frac{3}{n}\rightarrow M_R=\frac{56}{3}n\)
→ n = 3 và MR = 56 thỏa mãn
Vậy kim loại R là Fe














