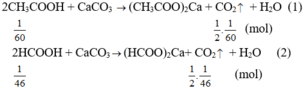1) a) Nếu cho kim loại natri và kim loại kali có cùng khối lượng bằng nhau (m gam) vào 2 ống nghiệm chứa nước dư, thì ống nghiệm nào sinh ra lượng khí H2 nhiều hơn?
b) Nếu cho a gam Na và b gam K vào 2 ống nghiệm chứa nước dư thì thu được cùng một lượng khí H2, tính tỉ lệ a/b?
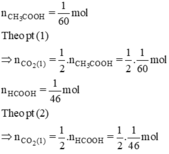
2) Cho 13g kẽm vào dd chứa 18,25g HCl
a) Tính khối lượng của muối tạo thành sau phản ứng
b) Nếu nhúng quỳ tím vào dd sau phản ứng kết thúc thì quỳ tím chuyển sang màu gì? Giai thích?
c) Cho toàn bộ lượng hidro nói trên đi qua 24g CuO đun nóng, sau phản ứng thu được chất rắn X. Tính khối lượng chất rắn X
3) Để hòa tan hết 2,94g hỗn hợp gồm 2 kim loại natri và kali thì cần vừa đủ 1,8 g nước
a) Tính thể tích khí hidro thu đc ở (đktc)
b)Tính thành phần phần trăm theo khối lượng của mối kim loại trong hôn hợp ban đầu