Cho 0,012 mol fe tác dụng với 0,02 mol CL2. Tính khối lượng muối tạo thành. giải chi tiết giúp e với.

Những câu hỏi liên quan
Cho 0,02 mol fe tác dụng với 0,012 mol CL2. Tính khối lượng muối tạo thành.
PTHH: \(2Fe+3Cl_2\underrightarrow{t^o}2FeCl_3\)
Xét tỉ lệ: \(\dfrac{0,02}{2}>\dfrac{0,012}{3}\) \(\Rightarrow\) Fe còn dư, Clo p/ứ hết
\(\Rightarrow n_{FeCl_3}=0,008\left(mol\right)\) \(\Rightarrow m_{FeCl_3}=0,008\cdot162,5=1,3\left(g\right)\)
Đúng 1
Bình luận (0)
Cho 23,8g hỗn hợp X gồm Cu,Fe,Al tác dụng vừa đủ với 14,56l Cl2 ở đktc thu được muối Y,mặt khác cứ 0,25 mol X tác dụng với dung dịch HCl dư thu được 0,2 mol khí H2. Tính % khối lượng các kim loại trong hỗn hợp X
Đốt cháy hoàn toàn m gam một chất béo X cần 1,61 mol O2, sinh ra 1,14 mol CO2 và 1,06 mol H2O. Mặt khác, cho 7,088 gam chất béo X tác dụng vừa đủ với dung dịch NaOH thì khối lượng muối tạo thành là A. 7,512 gam B. 7,612 gam C. 7,312 gam D. 7,412 gam
Đọc tiếp
Đốt cháy hoàn toàn m gam một chất béo X cần 1,61 mol O2, sinh ra 1,14 mol CO2 và 1,06 mol H2O. Mặt khác, cho 7,088 gam chất béo X tác dụng vừa đủ với dung dịch NaOH thì khối lượng muối tạo thành là
A. 7,512 gam
B. 7,612 gam
C. 7,312 gam
D. 7,412 gam
bài 1: cho hỗn hợp 11 gam Al và Fe tỉ lệ mol 2:1 vào trong bình đựng khí oxi dư rồi đem nung ở nhiệt độ cao. tính % khối lượng oxit tạo thành, biết Fe tác dụng với oxi tạo ra Fe2O3
bài 2: cho 16,6 gam Al và Fe ( Fe chiếm 67,4698% về khối lượng) vào khí oxi dư rồi đem đốt. tính % khối lượng oxit tạo thành, biết Fe tác dụng vs oxi tạo ra Fe2O3
Cho 10,8g Al tác dụng hết với đ HCl. Hãy cho biết: a) Thể tích khí H2 sinh ra ở đktc b) Tính khối lượng muối tạo thành c) Nếu dùng thể tích H2 trên để khử CuO tính khốu lượng Cu sinh ra
a) \(n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,4------------>0,4---->0,6
=> \(V_{H_2}=0,6.22,4=13,44\left(l\right)\)
b)
\(m_{AlCl_3}=0,4.133,5=53,4\left(g\right)\)
c)
PTHH: CuO + H2 --to--> Cu + H2O
0,6------>0,6
=> mCu = 0,6.64 = 38,4 (g)
Đúng 5
Bình luận (1)
`n_[Al]=[10,8]/27=0,4(mol)`
`2Al + 6HCl -> 2AlCl_2 + 3H_2 \uparrow`
`0,4` `0,4` `0,6` `(mol)`
`a)V_[H_2]=0,6.22,4=13,44(l)`
`b)m_[AlCl_2]=0,4.98=39,2(g)`
`c)`
`H_2 + CuO` $\xrightarrow{t^o}$ `Cu + H_2 O`
`0,4` `0,4` `(mol)`
`=>m_[Cu]=0,4.64=25,6(g)`
cho 23.2 gam hỗn hợp gồm cu và fe tác dụng hết với 5.6 lít khí oxi ở đktc. tính % về khối lượng của mỗi oxit tạo thành
nO2 = \(\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Pt: 2Cu + O2 \(\rightarrow\) 2CuO
x 0,5x x
3Fe + 2O2 \(\rightarrow\) Fe3O4
y 2/3y 1/3y
Theo bài ta có hpt:
\(\left\{{}\begin{matrix}64x+56y=23,2\\0,5x+\dfrac{2}{3}y=0,25\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}x=0,1\\y=0,3\end{matrix}\right.\)
mCuO = 0,1.80 = 8 g
mFe3O4 = 0,3.232 = 69,6g
=> %mCuO = \(\dfrac{8}{8+69,6}.100\%=10,3\%\)
%mFe3O4 = 100 - 10,3 = 89,7%
Đúng 2
Bình luận (0)
Cho X, Y là hai chất thuộc dãy đồng đẳng của axit acrylic và MX MY; Z là ancol có cùng số nguyên tử cacbon với X; T là este hai chức tạo bởi X,Y và Z. Đốt cháy hoàn toàn 5,58 gam hỗn hợp E gồm X, Y, Z, T cần vừa đủ 6,608 lít khí O2 (đktc) thu được khí CO2 và 4,68 gam nước. Mặt khác, cho 5,58 gam E tác dụng tối đa với dung dịch chứa 0,02 mol Br2. Khối lượng muối thu được khi cho cùng lượng E trên tác dụng với KOH dư là A. 5,44 gam. B. 4,68 gam...
Đọc tiếp
Cho X, Y là hai chất thuộc dãy đồng đẳng của axit acrylic và MX < MY; Z là ancol có cùng số nguyên tử cacbon với X; T là este hai chức tạo bởi X,Y và Z. Đốt cháy hoàn toàn 5,58 gam hỗn hợp E gồm X, Y, Z, T cần vừa đủ 6,608 lít khí O2 (đktc) thu được khí CO2 và 4,68 gam nước. Mặt khác, cho 5,58 gam E tác dụng tối đa với dung dịch chứa 0,02 mol Br2. Khối lượng muối thu được khi cho cùng lượng E trên tác dụng với KOH dư là
A. 5,44 gam.
B. 4,68 gam.
C. 2,34 gam
D. 2,52 gam.
Chọn C.
Gọi X, Y (a mol); Z (b mol) và T (c mol).
Xét phản ứng đốt cháy: ![]()
Áp dụng độ bất bão hoà, ta có: n C O 2 - n H 2 O = a - b + 3 c = - 0 , 025 ( 2 )
Xét phản ứng với dung dịch Br2, ta có: a + 2c = 0,02 (3)
Từ (1), (2) suy ra: a = 0,01; b = 0,05 và c = 0,005.
![]() (dựa vào giá trị C trung bình)
(dựa vào giá trị C trung bình)
Xét phản ứng với KOH, ta có:
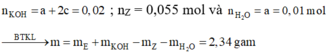
Đúng 0
Bình luận (0)
Cho X, Y là hai chất thuộc dãy đồng đẳng của axit acrylic và MX MY; Z là ancol có cùng số nguyên tử cacbon với X; T là este hai chức tạo bởi X,Y và Z. Đốt cháy hoàn toàn 5,58 gam hỗn hợp E gồm X, Y, Z, T cần vừa đủ 6,608 lít khí O2 (đktc) thu được khí CO2 và 4,68 gam nước. Mặt khác, cho 5,58 gam E tác dụng tối đa với dung dịch chứa 0,02 mol Br2. Khối lượng muối thu được khi cho cùng lượng E trên tác dụng với KOH dư là A. 5,44 gam B. 4,68 gam...
Đọc tiếp
Cho X, Y là hai chất thuộc dãy đồng đẳng của axit acrylic và MX < MY; Z là ancol có cùng số nguyên tử cacbon với X; T là este hai chức tạo bởi X,Y và Z. Đốt cháy hoàn toàn 5,58 gam hỗn hợp E gồm X, Y, Z, T cần vừa đủ 6,608 lít khí O2 (đktc) thu được khí CO2 và 4,68 gam nước. Mặt khác, cho 5,58 gam E tác dụng tối đa với dung dịch chứa 0,02 mol Br2. Khối lượng muối thu được khi cho cùng lượng E trên tác dụng với KOH dư là
A. 5,44 gam
B. 4,68 gam
C. 2,34 gam.
D. 2,52 gam
cho 11,2g Fe tác dụng với dung dịch axit clohiđric theo sơ đồ sau
Fe+2HCl→FeCl2+H2
a, tính khối lượng FeCl2 tạo thành
b, tinhs thể tích H2 thu được ở đktc
c.tính khối lượng HCl theo 2 cách
Số mol của Fe là :
nFe = 11,2/56 = 0,2 (mol)
Ta có PTHH :
Fe + 2HCl \(\rightarrow\) FeCl2 + H2\(\uparrow\)
1 mol 2 mol 1 mol 1 mol
0,2 mol 0,4 mol 0,2 mol 0,2 mol
a) Khối lượng FeCl2 tạo thành là :
mFeCl2 = 0,2.127 = 25,4 (g)
b) Thể tích H2 thu được ở đktc là :
VH2 = 0,2.22,4 = 4,48 (l)
c) Khối lượng của HCl là :
mHCl = 0,4.36,5 = 14,6 (g)
Đúng 0
Bình luận (3)
PTHH: Fe + 2HCl ===> FeCl2 + H2
a) nFe = 11,2 / 56 = 0,2 (mol)
Theo phương trình, nFeCl2 = nFe = 0,2 (mol)
=> Khối lượng FeCl2: mFeCl2 = 0,2 x 127 = 25,4 gam
b) Theo phương trình, nH2 = nFe = 0,2 (mol)
=> Thể tích H2 thu được: VH2(đktc) = 0,2 x 22,4 = 4,48 lít
c)
Cách 1: Áp dụng định luật bảo toàn khối lượng
=> mHCl = mFeCl2 + mH2 - mFe = 25,4 + 0,2 x 2 - 11,2 = 14,6 gam
Cách 2: Theo phương trình, nHCl = 2.nFe = 0,4 (mol)
=> mHCl = 0,4 x 36,5 = 14,6 gam
Đúng 0
Bình luận (1)






















