Cho khí hidro tác dụng với 3g một loại oxit sắt cho2,1 g Fe. Tìm công thức phân tử của oxit sắt
cho 16 g một loại oxit sắt hợp chất của sắt và ôxi tác dụng hết với khiro thu được 11,2g fe tìm công thức hóa học của oxit sắt
bạn ghi lại đề đi, ghi cả dấu lun nha
Khối lượng Fe ở chất phản ứng = Fe ở chất sản phẩm
+) FeO
mFe= \(\frac{16.56}{56+16}\)= 12,4 g
mà sau pư, klg Fe =11,2
=> công thức này sai
+) Fe2O3
mFe= \(\frac{16.56.2}{56.2+16.3}\)= 11,2g
klg Fe trong Fe2O3 bằng khối lượng Fe sau pư
=> Đây là công thức đúng
Cho 7,2 gam một loại oxit sắt tác dụng hoàn toàn với khí hiđro cho 5,6 gam sắt . Tìm công thức oxit sắt
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Gọi: CTHH của oxit là FexOy
Ta có: mO = 7,2 - mFe = 1,6 (g) \(\Rightarrow n_O=\dfrac{1,6}{16}=0,1\left(mol\right)\)
⇒ x:y = 0,1:0,1 = 1:1
→ CTHH cần tìm là FeO.
Bài 5. a) Hãy xác định công thức của một loại oxit sắt, biết rằng khi cho 32 gam oxit sắt này tác dụng hoàn toàn với khí cacbon oxit thì thu được 22,4 gam chất rắn. Biết khối lượng mol phân tử của oxit sắt là 160 gam/mol. b) Chất khí sinh ra được hấp thụ hoàn toàn bằng nước vôi trong dư. Tính khối lượng kết tủa thu được.
a) Gọi CTHH của oxit sắt là $Fe_2O_n$
$Fe_2O_n + nCO \xrightarrow{t^o} 2Fe +nCO_2$
$n_{Fe} = \dfrac{22,4}{56} = 0,2(mol)$
$\Rightarrow n_{Fe_2O_n} = \dfrac{1}{2}n_{Fe} = 0,2(mol)$
$M_{oxit} = 56.2 + 16n = \dfrac{32}{0,2}=160$
Suy ra : n = 3
Vậy oxit cần tìm là $Fe_2O_3$
b) $n_{CO_2} = \dfrac{3}{2}n_{Fe} = 0,6(mol)$
$CO_2 +C a(OH)_2 \to CaCO_3 + H_2O$
$n_{CaCO_3} = n_{CO_2} = 0,6(mol)$
$m_{CaCO_3} = 0,6.100 = 60(gam)$
Cho kim loại sắt Fe tác dụng vừa đủ với 147gam dung dịch H2SO4 có nồng độ 20℅ thu được muối và khí hidro. Dân toàn bộ khí hidro qua 16g oxit kim loại có hóa trị III. Xác định công thức hóa học của oxit cầu cíu các cao nhân
\(n_{H_2SO_4}=\dfrac{147.20\%}{98}=0,3\left(mol\right)\\ Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ n_{H_2}=n_{axit}=0,3\left(mol\right)\\ Đặt:A_2O_3\\ A_2O_3+3H_2\rightarrow\left(t^o\right)2A+3H_2O\\ n_{oxit}=\dfrac{n_{H_2}}{3}=\dfrac{0,3}{3}=0,1\left(mol\right)\\ M_{oxit}=\dfrac{16}{0,1}=160\left(\dfrac{g}{mol}\right)=2M_A+48\\ \Rightarrow M_A=56\left(\dfrac{g}{mol}\right)\\ \Rightarrow A:Sắt\left(Fe=56\right)\\ \Rightarrow Oxit:Fe_2O_3\)
Cho 7,2 gam một loại oxit sắt tác dụng hoàn toàn với khí hiđro cho 5,6 gam sắt. Công thức oxit sắt là
A. F e O
B. F e 2 O 3
C. F e 3 O 4
D. F e O 2
Đáp án: A
Đặt oxit sắt là FexOy
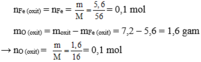
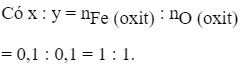
Vậy oxit là FeO.
cho 16 gam một loại oxit sắt hợp chất của sắt và oxi tác dụng hết với khí hiđro thu được 11,2g fe tìm CTHHcua oxit sắt
\(n_{Fe}=0,2mol\)
\(Fe_xO_y+yH_2\rightarrow xFe+yH_2O\)
\(\dfrac{0,2}{x}\)..........................0,2
\(M_{Fe_xO_y}=\dfrac{16}{\dfrac{0,2}{x}}=80x\Leftrightarrow56x+16y=80x\Leftrightarrow\dfrac{x}{y}=\dfrac{2}{3}\)
\(\Rightarrow x=2;y=3\)
Oxit sắt là: \(Fe_2O_3\)
Đặt CTHH: FexOy
\(Fe_xO_y+yH_2\underrightarrow{t^o}xFe+yH_2O\)
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(n_{Fe_xO_y}=\dfrac{0,2}{x}\left(mol\right)\)
\(M_{Fe_xO_y}=\dfrac{16}{\dfrac{0,2}{x}}=80x\)
\(56x+16y=80x\)
\(\Leftrightarrow16y=24x\)
\(\Leftrightarrow\)\(\dfrac{x}{y}=\dfrac{16}{24}=\dfrac{2}{3}\)
\(\Rightarrow x=2;y=3\)
CTHH của oxit sắt: Fe2O3
Ở nhiệt độ cao, người ta cho 1,68 gam sắt Fe tác dụng hoàn toàn với 0,64g khí oxi, tạo thành sắt từ oxit Fe3O4.
a) Lập PTHH của phản ứng trên và cho biết tỉ lệ số nguyên tử, số phân tử
b) Viết công thức khối lượng và tính khối lượng sắt từ oxit Fe3O4 tạo thành?
b, PTHH: 3Fe + 2O2 \(\underrightarrow{t^o}\) Fe3O4
Số nguyên tử Fe : Số phân tử O2 : Số phân tử Fe3O4 là 3 : 2: 1
b, Công thức khối lượng:
mFe + mO2 = mFe3O4
=> mFe3O4 = mFe + mO2 = 1,68 + 0,64 = 2,32 ( g )
Dùng khí hiđro để khử hoàn toàn 6 gam một oxit sắt thì thu được 4,2 gam Fe. Tìm công thức phân tử của oxit sắt.
Đặt công thức phân tử của oxit sắt là F e x O y (sắt có hóa trị 2x/y)
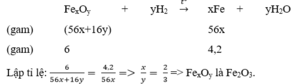
cho 15,6 gam hỗn hợp X gồm Cuo và một oxit sắt tác dụng với khí hidro(dư) đun nóng,kết thúc thu được hai kim loại.cho hai kim loại vào dung dịch HCl dư,kết thúc thu được 3,36 lít khí H2 và có 3,6 gam chất rắn.Tìm công thức oxit sắt đã dùng.
3,6 gam chất rắn không tan là Cu
\(n_{CuO} = n_{Cu} = \dfrac{3,6}{64}= 0,05625(mol)\\ Fe + 2HCl \to FeCl_2 + H_2\\ n_{Fe} = n_{H_2} =\dfrac{3,36}{22,4}= 0,15(mol)\\ m_X = m_{CuO} + m_{oxit\ sắt} \Rightarrow m_{oxit\ sắt} =15,6 -0,05625.80 = 11,1(gam)\\ m_{Oxit\ sắt} = m_{Fe} + m_{O(trong\ oxit\ sắt)}\\ Rightarrow n_O = \dfrac{11,1-0,15.56}{16} = 0,16875(mol)\\ \dfrac{n_{Fe}}{n_O} = \dfrac{0,15}{0,16875} = \dfrac{8}{9}\)
(Sai đề)