Một nguyên tử có tổng số hạt 60 . Xác định các loại hạt của nguyên tử và tên nguyên tố

Những câu hỏi liên quan
Một nguyên tử có tổng số hạt là 36 . Trong đó số hạt mang điện chiếm 33,33% tổng số hạt . Xác định các loại hạt của nguyên tử và tên nguyên tố
Tổng số hạt mang điện = \(\frac{33,33\times36}{100}=12\) hạt
<=> Số p + Số e = 12 \
<=> 2 x Số p = 12 ( vì số e = số p)
<=> Số p = Số e = 6
=> Số n = 36 - 12 = 24 hạt
=> Tên nguyên tố : Cacbon
Đúng 0
Bình luận (0)
Gọi p, e, n lần lượt là số proton, electron, notron trong nguyên tử
Theo đề bài ta có: p + e + n = 36 (1)
Ta cũng có: n = 33,33%.(p + e +n)
=> n = 33,33%.36 = 12 (hạt) (2)
Thế (2) vào (1) => p + e = 36 - n = 36 - 12 = 24
mà số p = số e => p + p = 24
=> 2p = 24
=> p = 12 = e
Vậy số hạt proton, electron trong nguyên tử là 12 hạt, notron là 12 hạt.
Vậy nguyên tử thuộc nguyên tố hóa học Magie ( Kí hiệu Mg )
Đúng 0
Bình luận (0)
một nguyên tử nguyên tố a có tổng số các loại hạt trong nguyên tử là 34,trong đó số hạt mang điện tích nhiều hơn hạt ko mang điện tích là 10.xác định số lượng mỗi loại hạt,từ đó xác định tên và kí hiệu hóa học của nguyên tử nguyên tố đó
`#3107.101107`
Gọi các hạt trong nguyên tử là `p, n, e`
Tổng số hạt trong nguyên tử là `34`
`=> p + n + e = 34`
Mà trong nguyên tử, số `p = e`
`=> 2p + n = 34`
Số hạt mang điện nhiều hơn số hạt không mang điện
`=> 2p - n = 10 => n = 2p - 10`
`=> 2p + 2p - 10 = 34`
`=> 4p = 34 + 10`
`=> 4p = 44`
`=> p = 11 => p = e = 11`
Số hạt n có trong nguyên tử là: `34 - 11 - 11 = 12`
- Tên của nguyên tử nguyên tố a: Sodium (Natri)
- KHHH: Na.
Đúng 3
Bình luận (0)
một nguyên tử nguyên tố A có tổng số các loại hạt trong nguyên tử là 34 trong số hạt mang điện nhiều hơn số hạt không mang điện là 10.Xác định số lượng mỗi loại hạt,từ đó xác định tên và kí hiệu hóa học của 1 số nguyên tố sau: CA,CALI,CU,FE Giúp mình với ạ
Đúng 0
Bình luận (0)
bài 1 : một nguyên tử có tổng số các hạt là 34 hạt . Xác định điện tích hạt nhân số khối nguyên tử , tên nguyên tố, cấu hình electron , xác định vị trí trong bảng tuần hoàn . Nêu tính chất hóa học cơ bảnbài 2 : một nguyên tử có tổng số các hạt là 60 hạt , biết số hạt mang điện tích nhiều hơn số hạt không mang điện tích là 20 hạt. Xác định điện tích hạt nhân số khối nguyên tử và viết cấu hình electron.
Đọc tiếp
bài 1 : một nguyên tử có tổng số các hạt là 34 hạt . Xác định điện tích hạt nhân số khối nguyên tử , tên nguyên tố, cấu hình electron , xác định vị trí trong bảng tuần hoàn . Nêu tính chất hóa học cơ bản
bài 2 : một nguyên tử có tổng số các hạt là 60 hạt , biết số hạt mang điện tích nhiều hơn số hạt không mang điện tích là 20 hạt. Xác định điện tích hạt nhân số khối nguyên tử và viết cấu hình electron.
một nguyên tử của nguyên tố x có tổng ba loại hạt là 34 . Trong số đó hạt không mang điện tích là 12 hạt
a)Xác định số hạt của mỗi loại ?.
B) cho bik tên nguyên tử nguyên tố x và kí hiệu của nó
a) Theo đề ta có:
p + n + e = 34
=> p + e = 34 - n = 34 - 12 = 22
Vì số p = số e
=> p = e = 22 : 2 = 11 (hạt)
b) X là Natri (Na)
Đúng 2
Bình luận (1)
Nguyên tử nguyên tố R có tổng số hạt các loại là 60 hạt. Trong hạt nhân của nguyên tử đó, số hạt mang điện dương bằng số hạt không mang điện.a.Tính số hạt mỗi loại và viết kí hiệu nguyên tử R?b. Viết cấu hình electron nguyên tử và xác định vị trí của R trong bảng tuần hoàn, giải thích?c. Viết cấu hình e của ion tạo bởi R, giải thích?d.Đốt cháy hết m(g) R trong 4,48 lít khí oxi (đktc). Tính m?
Đọc tiếp
Nguyên tử nguyên tố R có tổng số hạt các loại là 60 hạt. Trong hạt nhân của nguyên tử đó, số hạt mang điện dương bằng số hạt không mang điện.
a.Tính số hạt mỗi loại và viết kí hiệu nguyên tử R?
b. Viết cấu hình electron nguyên tử và xác định vị trí của R trong bảng tuần hoàn, giải thích?
c. Viết cấu hình e của ion tạo bởi R, giải thích?
d.Đốt cháy hết m(g) R trong 4,48 lít khí oxi (đktc). Tính m?
a) Có \(\left\{{}\begin{matrix}p+n+e=2p+n=60\\p=n\end{matrix}\right.=>\left\{{}\begin{matrix}p=e=20\\n=20\end{matrix}\right.\)
=> R là Ca
b)
Cấu hình của Ca: 1s22s22p63s23p64s2
Có 20e => Ca nằm ở ô thứ 20
Có 4 lớp e => Ca thuộc chu kì 4
Có 2e lớp ngoài cùng => Ca thuộc nhóm IIA
c)
Nguyên tử Ca nhường 2e để đạt đến cấu hình bền của khí hiếm, tạo ra ion Ca2+
Cấu hình ion Ca2+ : 1s22s22p63s23p6
d) \(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: 2Ca + O2 --to--> 2CaO
_____0,4<--0,2
=> mCaO = 0,4.40 = 16 (g)
Đúng 2
Bình luận (0)
Nguyên tử của một nguyên tố X có tổng số các loại hạt là 34, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10. a. Xác định số p, số n, số e của nguyên tử nguyên tố X.b. Hãy cho biết tên, KHHH và khối lượng nguyên tố X.c. Nguyên tố X ở ô số bao nhiêu? Ô nguyên tố này cho em biết được gì? d. Xác định vị trí của X trong BTH?
Đọc tiếp
Nguyên tử của một nguyên tố X có tổng số các loại hạt là 34, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10.
a. Xác định số p, số n, số e của nguyên tử nguyên tố X.
b. Hãy cho biết tên, KHHH và khối lượng nguyên tố X.
c. Nguyên tố X ở ô số bao nhiêu? Ô nguyên tố này cho em biết được gì?
d. Xác định vị trí của X trong BTH?
\(a,\) \(X=p+e+n=34\)
Mà trong 1 nguyên tử, số \(p=e\)
\(\Rightarrow2p+n=34\)
Trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 10
\(\Rightarrow2p-n=10\)
\(n=2p-10\)
Trong nguyên tử có:
\(2p+2p-10=34\)
\(4p-10=34\)
\(4p=34+10\)
\(4p=44\)
\(p=44\div4=11\)
\(\Rightarrow p=11,e=11,n=12\)
\(b,\) Nguyên tố x là \(Natri,\) \(KHHH:Na\) \(K.L.N.T=23\)
\(c,\) Nguyên tố x ở ô số 11, ô nguyên tố này cho em biết:
Số hiệu nguyên tử: 11
Tên gọi hh: Sodium (Natri)
KHHH: Na
KLNT: 23 <amu>.
\(d,\) Nguyên tố x nằm ở chu kì 3, nhóm IA.
Đúng 2
Bình luận (2)
cho mình hỏi bài này làm sao vậy Bài 1 : nguyên tử X có tổng số hạt các loại là 28 hạt . Số notron nhiều hơn số proton 1 hạt a) xác định số hạt mỗi loại ? b) tính số khối của hạt nhân nguyên tử X c) viết cấu hình electron nguyên tử d) nguyên tố X thuộc loại nguyên tố nào ( kim loại , phi kim , khí hiếm ) ?.Bài 2 : nguyên tử của nguyên tố B có tổng số các hạt cấu tạo là 93 . Trong đó số hạt mang điện nhiều hơn không mang điện là 23 hạt .Xác định số hiệu nguyên tử của nguyên tố và viết cấu hình el...
Đọc tiếp
cho mình hỏi bài này làm sao vậy
Bài 1 : nguyên tử X có tổng số hạt các loại là 28 hạt . Số notron nhiều hơn số proton 1 hạt
a) xác định số hạt mỗi loại ?
b) tính số khối của hạt nhân nguyên tử X
c) viết cấu hình electron nguyên tử
d) nguyên tố X thuộc loại nguyên tố nào ( kim loại , phi kim , khí hiếm ) ?.
Bài 2 : nguyên tử của nguyên tố B có tổng số các hạt cấu tạo là 93 . Trong đó số hạt mang điện nhiều hơn không mang điện là 23 hạt .Xác định số hiệu nguyên tử của nguyên tố và viết cấu hình electron nguyên tử của nó .
Bài 3 : nguyên tử của nguyên tố A có tổng số các hạt cấu tạo là 40 . Xác định số hiệu nguyên tử của nguyên tố và viết cấu hình electron nguyên tử của nó .
ta co p+e+n=93 mà p=e=z => 2z+n=93
2z-n=23 ( vì số hạt mang điện nhiều hơn số hạt ko mang điện là 23)
tu 2 pt trên ta có z =29,,n=35
=> số hiệu nguyên tử của B = Z = 29
cấu hình electron
\(1s^22s^22p^63s^23p^64s^23d^9\)
Đúng 0
Bình luận (0)
đối với các dạng bài này , bạn cần nhớ kiến thức như sau :
Tổng số hạt trong nguyên tử = 2p + n ( gồm có 3 loại hạt : n , p, e trong đó p=e)
số hạt mang điện là 2p
số hạt không mang điện là n
số hiệu nguyên tử là Z= p = e = số thứ tự nhóm .
Sau khi xác định được p ,, tức là cũng xác định được e thì
cấu hình viết theo dãy trật tự các mức năng lượng
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10.......
Các nguyên tử có 1, 2, 3e ở lớp ngoài cùng là các nguyên tử kim loại, trừ H, He và B.Các nguyên tử có 5, 6, 7e ở lớp ngoài cùng thường là các nguyên tố phi kim. Các nguyên tử có 4e ở lớp ngoài cùng có thể là nguyên tử kim loại hoặc phi kim
Đúng 0
Bình luận (3)
bài 1 : a/
tacó p+e+n=28
<=> z+z+n=28
> 2z+n=28 1
vì n lớn hơn p là 1 nên ta có pt:
n-z=1hay -z+n=1 2
từ 1 và 2 ta có hệ phương trình
2z+n=28
-z+n=1
=>z= 9,n=10
b/ số khối A = Z + N = 9 + 10 = 19
c/ Cấu hình electron nguyên tử :\(1s^22s^22p^63s^23p^64s^1\)
d/ Nguyên tố X là kim loại cụ thể ở đây là Kali
Đúng 0
Bình luận (3)
Xem thêm câu trả lời
1/ Nguyên tử của một nguyên tố X có tổ g số hạt là 52 trong đó số hạt mang điện tích nhiều hơn số hạt không mang điện tích là 16. Xác định tên nguyên tử
2/ Nguyên tử của nguyên tố Y có tổng số hạt là 18 trong đó số hạt mang điện tích gấp đôi số hạt không mang điện tichu. Xác định tên nguyên tố
Nếu tổng số hạt < 60 có thể áp dụng công thức tính nhanh như sau: Số hạt proton = số điện tích hạt nhân = số electron = Z = [tổng/3] (phần nguyên tổng số hạt chia cho 3).
1/ Z = [52/3] = 17, 2Z - N = 16 suy ra N = 18, số khối A = Z + N = 35. Nguyên tố cần xác định là Clo.
2/ Z = [18/3] = 6, 2Z = 2N suy ra N = 6, số khối A = 12. Nguyên tố cần xác định là Cacbon.
Đúng 1
Bình luận (0)
Theo bài ra ta có :\(\left[{}\begin{matrix}p+e+n=52\\p=e\\\left(p+e\right)-n=16\end{matrix}\right.< =>\left[{}\begin{matrix}2p+n=52\\p=e\\2p=16+n\end{matrix}\right.< =>\left[{}\begin{matrix}16+n+n=52\\p=e\\2p=16+n\end{matrix}\right.< =>\left[{}\begin{matrix}2n+16=52\\p=e\\2p=16+n\end{matrix}\right.=>\left[{}\begin{matrix}2n=36\\p=e\\2p=16+n\end{matrix}\right.=>n=18=>p=e=\dfrac{52-18}{2}=17\)Vậy X thuộc nguyên tố Clo (Cl)
Chúc bạn học tốt !!!
Đúng 1
Bình luận (0)
Ta có :\(\left[{}\begin{matrix}p+n+e=18\\p=e\\\left(p+e\right)=2n\end{matrix}\right.< =>\left[{}\begin{matrix}2p+n=18\\p=e\\2p=2n\end{matrix}\right.< =>\left[{}\begin{matrix}2n+n=18\\p=e\\p=n\end{matrix}\right.=>3p=18=>p=n=e=6\)Vậy Y thuộc ngto Cacbon(C)
Chúc bạn học tốt
Đúng 1
Bình luận (0)
Xem thêm câu trả lời
nguyên tử của một nguyên tố có tổng số các loại hạt là 28, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 8. Xác định số p, số n, số e của nguyên tử nguyên tố đó. Vẽ mô hình nguyên tử. Xác định vị trí của nguyên tố đó trong bảng tuần hoàn.
Tổng số các loại hạt là 28, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 8
⇒ Số neutron là 10 hạt
Số proton là 9 hạt
Số electron là 9 hạt
⇒ Nguyên tố Fluorine - ô số 9, chu kì 2, nhóm VIIA trong bảng tuần hoàn
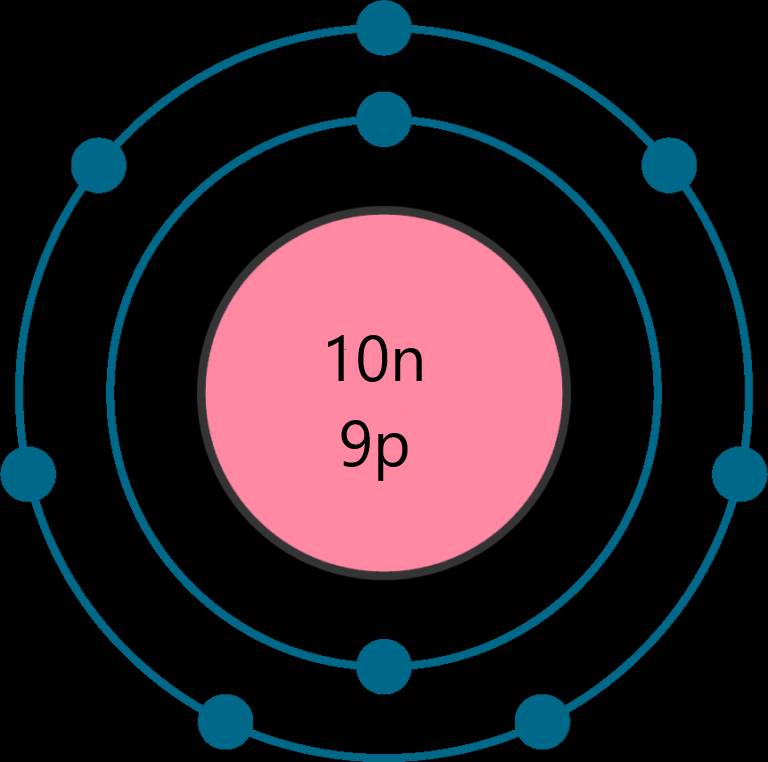
Đúng 1
Bình luận (0)






















