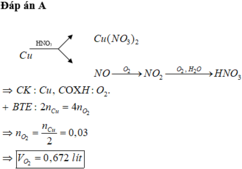
Hòa tan hoàn toàn 3,84g Cu trong dd HNO3 dư, thu đc khí NO (sp khử duy nhất).Trộn NO trên với O2 dư, thu đc hh khí Y.Sục Y trong nc dư, thu đc dd Z và còn lại khí O2 duy nhất .Tổng thể tích O2 (đktc) đã pư là bao nhiêu ?

Những câu hỏi liên quan
Hòa tan hoàn toàn 3,84 gam Cu trong dung dịch HNO3 dư thu được khí NO (sản phẩm khử duy nhất). Trộn NO trên với O2 dư, thu được hỗn hợp khí Y. Sục Y vào nước dư, thu được dung dịch Z và còn lại khí O2 duy nhất. Tổng thể tích O2 (đktc) đã phản ứng là A. 0,896 lít B. 0,672 lít C. 0,504 lít C. 0,504 lít
Đọc tiếp
Hòa tan hoàn toàn 3,84 gam Cu trong dung dịch HNO3 dư thu được khí NO (sản phẩm khử duy nhất). Trộn NO trên với O2 dư, thu được hỗn hợp khí Y. Sục Y vào nước dư, thu được dung dịch Z và còn lại khí O2 duy nhất. Tổng thể tích O2 (đktc) đã phản ứng là
A. 0,896 lít
B. 0,672 lít
C. 0,504 lít
C. 0,504 lít
Hòa tan hoàn toàn 3,84 gam Cu trong dung dịch
H
N
O
3
dư, thu được khí NO (sản phẩm khử duy nhất). Trộn lượng NO trên với
O
2
dư, thu được hỗn hợp khí Y. Sục Y vào nước dư, thu được dung dịch Z và còn lại khí
O
2
duy nhất. Tổng thể tích
O
2
(đktc) đã phản ứng là A. 0,672 lít. B. 0,896 lít. C....
Đọc tiếp
Hòa tan hoàn toàn 3,84 gam Cu trong dung dịch H N O 3 dư, thu được khí NO (sản phẩm khử duy nhất). Trộn lượng NO trên với O 2 dư, thu được hỗn hợp khí Y. Sục Y vào nước dư, thu được dung dịch Z và còn lại khí O 2 duy nhất. Tổng thể tích O 2 (đktc) đã phản ứng là
A. 0,672 lít.
B. 0,896 lít.
C. 0,504 lít.
D. 0,784 lít.
Hòa tan hoàn toàn 3,84 gam Cu trong dung dịch HNO3 dư, thu được hỗn hợp khí X gồm NO2 và NO (không còn sản phẩm khử khác). Trộn X với V lít O2 (đktc) thu được hỗn hợp khí Y. Cho Y tác dụng với H2O, thu được dung dịch Z, còn lại 0,25V lít O2 (đktc). Giá trị của V là A. 0,672. B. 0,896. C. 0,504. D. 0,784.
Đọc tiếp
Hòa tan hoàn toàn 3,84 gam Cu trong dung dịch HNO3 dư, thu được hỗn hợp khí X gồm NO2 và NO (không còn sản phẩm khử khác). Trộn X với V lít O2 (đktc) thu được hỗn hợp khí Y. Cho Y tác dụng với H2O, thu được dung dịch Z, còn lại 0,25V lít O2 (đktc). Giá trị của V là
A. 0,672.
B. 0,896.
C. 0,504.
D. 0,784.
Đáp án : B
Gọi sốm ol NO và NO2 lần lượt là x và y mol
Bảo toàn e : 2nCu = 3x + y = 0,12 mol
Lại có : NO + ½ O2 à NO2
4NO2 + O2 + 2H2O à 4HNO3
=> nO2 pứ = 3 x + y 4 = V - 0 , 25 V 22 , 4
=> V = 0,896 lít
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 15,2gam hỗn hợp A gồm Cu và Fe3O4 bằng dd H2SO4 loãng(vừa đủ) thu đc dd B.Cô cạn dd B thì thu đc 34,4g muối.Mặt khác,nếu hòa tan hoàn toàn 3,648g A bằng lượng dư dd H2SO4 đặc,nóng thì thu đc V lít khí(đktc) SO2(sản phẩm khử duy nhất).Hấp thụ hoàn toàn V lít khí SO2 vào 300g dd Ca(OH)2 a% thì thấy khối lượng dd sau phản ứng tăng thêm 0,528g và thu đc m gam kết tủa.a)Tính khối lượng của từng muối có trong Bb) Xác định giá trị của a và b
Đọc tiếp
Hòa tan hoàn toàn 15,2gam hỗn hợp A gồm Cu và Fe3O4 bằng dd H2SO4 loãng(vừa đủ) thu đc dd B.Cô cạn dd B thì thu đc 34,4g muối.Mặt khác,nếu hòa tan hoàn toàn 3,648g A bằng lượng dư dd H2SO4 đặc,nóng thì thu đc V lít khí(đktc) SO2(sản phẩm khử duy nhất).Hấp thụ hoàn toàn V lít khí SO2 vào 300g dd Ca(OH)2 a% thì thấy khối lượng dd sau phản ứng tăng thêm 0,528g và thu đc m gam kết tủa.
a)Tính khối lượng của từng muối có trong B
b) Xác định giá trị của a và b
Nhiệt phân 98 gam KClO3 (có xt MnO2) sau một thời gian thu được 93,2 gam chất rắn và khí A. Cho toàn bộ lượng khí A pư hết với hh kim loại X gồm Mg , Fe thu đc hh chất rắn Y cân nặng 15,6 gam . Hòa tan hoàn toàn hh Y bằng dd H2SO4 đặc nóng dư thu đc 0,56 lít SO2 ( đktc, sp khử duy nhất) .Tính thành phần % khối lượng của Mg trong hh
Hoà tan hoàn toàn kim loại A vào dd HNO3 loãng thu được dd X và 0,2 mol NO (sp khử duy nhất). Tương tự cũng hoà tan hoàn toàn kim loại B vào dd HNO3 trên chỉ thu được dd Y. trộn X với Y thu được dd Z. Trộn X với Y thu được dd Z. cho NaOH dư vào Z thu được 0,1 mol khí và một kết tủa D. Nung D đến khối lượng không đổi được 40 g chất rắn. Biện luận để tìm khối lượng nguyên tử của A,B. Biết rằng A, B có hoá trị II, tỉ lệ khối lượng nguyên tử của chúng là 3:8 và khối lượng nguyên tử của chúng đều là...
Đọc tiếp
Hoà tan hoàn toàn kim loại A vào dd HNO3 loãng thu được dd X và 0,2 mol NO (sp khử duy nhất). Tương tự cũng hoà tan hoàn toàn kim loại B vào dd HNO3 trên chỉ thu được dd Y. trộn X với Y thu được dd Z. Trộn X với Y thu được dd Z. cho NaOH dư vào Z thu được 0,1 mol khí và một kết tủa D. Nung D đến khối lượng không đổi được 40 g chất rắn. Biện luận để tìm khối lượng nguyên tử của A,B. Biết rằng A, B có hoá trị II, tỉ lệ khối lượng nguyên tử của chúng là 3:8 và khối lượng nguyên tử của chúng đều là số nguyên lớn hơn 23 và nhỏ hơn 70.
Giải
mình thấy trên mạng giải thế này :
nNO=0,2=> nA=0,3
nNH3= 0,1=>nB=0,4
Các bạn giải thích giúp mình tại sao từ nNO=0,2 thì lại được nA=0,3
Hoà tan hoàn toàn kim loại A vào dd HNO3 loãng thu được dd X và 0,2 mol NO (sp khử duy nhất). Tương tự cũng hoà tan hoàn toàn kim loại B vào dd HNO3 trên chỉ thu được dd Y. trộn X với Y thu được dd Z. Trộn X với Y thu được dd Z. cho NaOH dư vào Z thu được 0,1 mol khí và một kết tủa D. Nung D đến khối lượng không đổi được 40 g chất rắn. Biện luận để tìm khối lượng nguyên tử của A,B. Biết rằng A, B có hoá trị II, tỉ lệ khối lượng nguyên tử của chúng là 3:8 và khối lượng nguyên tử của chúng đều là...
Đọc tiếp
Hoà tan hoàn toàn kim loại A vào dd HNO3 loãng thu được dd X và 0,2 mol NO (sp khử duy nhất). Tương tự cũng hoà tan hoàn toàn kim loại B vào dd HNO3 trên chỉ thu được dd Y. trộn X với Y thu được dd Z. Trộn X với Y thu được dd Z. cho NaOH dư vào Z thu được 0,1 mol khí và một kết tủa D. Nung D đến khối lượng không đổi được 40 g chất rắn. Biện luận để tìm khối lượng nguyên tử của A,B. Biết rằng A, B có hoá trị II, tỉ lệ khối lượng nguyên tử của chúng là 3:8 và khối lượng nguyên tử của chúng đều là số nguyên lớn hơn 23 và nhỏ hơn 70.
Giải
mình thấy trên mạng giải thế này :
nNO=0,2=> nA=0,3
nNH3= 0,1=>nB=0,4
Các bạn giải thích giúp mình tại sao từ nNO=0,2 thì lại được nA=0,3
Hòa tan hoàn toàn 1,23g hỗn hợp X gồm Cu và Al vào dd HNO3 đặc,nóng 1,344lit khí NO2(sản phẩm khử duy nhất) và dd Y.Sục từ từ khí NH3 dư vào dd Y,sau khi các p/ư xảy ra hoàn toàn thu dc m gam kết tủa.giá trị của m là?
ta có
bt kl 64nCu+27nAl=1.23
bt e 2nCu+3nAl=1.344:22.4
->nCu=0.015mol
nAl=0.01mol
h20+nh3->oh- +nh4+
cu2+ +2oh- ->cu(oh)2
0.015 0.015
al3+ +3oh- ->al(oh)3
0.01 0.01
m=0.015*98+0.01*78=2.25g
Đúng 0
Bình luận (0)
1.Hoà tan 5.6g Fe trong dd HNO3 6.3% Vừa thu đc V lit khí NO (đktc). Tính kl HNO3 đã dùng và C% của dd muối thu đc
2.hòa tan hoàn toàn ag FeSO4. 7H2O trong Nước thu đc dd A. Dd A làm mất màu 200ml dd KMnO4 1M trong H2So4 dư. Tính a?
Bài 1:
Ta có: \(n_{Fe}=0,1\left(mol\right)\)
PT: \(Fe+4HNO_3\underrightarrow{t^o}Fe\left(NO_3\right)_3+NO+2H_2O\)
___0,1_____0,4_____0,1_______0,1 (mol)
\(\Rightarrow m_{HNO_3}=0,4.63=25,2\left(g\right)\)
\(\Rightarrow m_{ddHNO_3}=\dfrac{25,2}{6,3\%}=400\left(g\right)\)
Ta có: m dd sau pư = mFe + m dd HNO3 - mNO = 5,6 + 400 - 0,1.30 = 402,6 (g)
\(\Rightarrow C\%_{Fe\left(NO_3\right)_3}=\dfrac{0,1.242}{402,6}.100\%\approx6,01\%\)
Bạn tham khảo nhé!
Đúng 2
Bình luận (0)
Bài 2 :
n KMnO4 = 0,2(mol)
$Mn^{+7} + 5e \to Mn^{+2}$
$Fe^{+2} \to Fe^{+3} + 1e$
Bảo toàn electron :
n FeSO4 = 5n KMnO4 = 0,2.5 = 1(mol)
n FeSO4.7H2O = n FeSO4 = 1(mol)
=> a = 1.278 = 278(gam)
Đúng 2
Bình luận (0)
Bài 1 :
n Fe = 5,6/56 = 0,1(mol)
Bảo toàn electron :
3n Fe = 3n NO
=> n NO = 0,1(mol)
n HNO3 = 4n NO = 0,4(mol)
=> m HNO3 = 0,4.63 = 25,2(gam)
=> m dd HNO3 = 25,2/6,3% = 400(gam)
Sau phản ứng :
n Fe(NO3)3 = n Fe = 0,1(mol)
m dd = 5,6 + 400 - 0,1.30 = 402,6(gam)
C% Fe(NO3)3 = 0,1.242/402,6 .100% = 6,01%
Đúng 0
Bình luận (1)
Xem thêm câu trả lời