Ngâm một vật bằng đồng có khối lượng 10 gam trong 250 gam dung dịch AgNO3 4%. Khi lấy vật ra thì khối lượng AgNO3 trong dung dịch giảm 17%.

Những câu hỏi liên quan
Ngâm một vật bằng đồng có khối lượng 10 gam trong 250 gam dung dịch AgNO3 4%.
Khi lấy vật ra thì khối lượng AgNO3 trong dung dịch giảm 17%.
a) Viết phương trình hoá học của phản ứhg và cho biết vai trò các chất tham gia phản ứng.
b) Xác định khối lượng của vật sau phản ứng.
Khối lượng AgNO3 = 250.4/100 = 10 (g)
Khối lượng AgNO3 trong dung dịch giảm 17% = khối lượng AgNO3 phản ứng = 1,7 (g)
⇒ Số mol AgNO3 = 0,01 mol
Phương trình phản ứng:
b)
Khối lượng vật bằng Cu = 10 - 0,005.64 + 0,01.108 = 10,76 (g)
Đúng 0
Bình luận (0)
Bài 5: Ngâm một vật bằng đồng có khối lượng 50 gam vào 250 gam dung dịch AgNO3 6%. Khi lấy vật ra thì khối lượng AgNO3 trong dung dịch giảm 17%.
a) Xác đinh khối lượng của vật lấy ra sau phản ứng. Biết toàn bộ lượng bạc sinh ra đều bám vào vật.
b) Tính nồng độ phần trăm các chất có trong dung dịch sau phản ứng khi lấy vật ra.
Đọc tiếp
Bài 5: Ngâm một vật bằng đồng có khối lượng 50 gam vào 250 gam dung dịch AgNO3 6%. Khi lấy vật ra thì khối lượng AgNO3 trong dung dịch giảm 17%.
a) Xác đinh khối lượng của vật lấy ra sau phản ứng. Biết toàn bộ lượng bạc sinh ra đều bám vào vật.
b) Tính nồng độ phần trăm các chất có trong dung dịch sau phản ứng khi lấy vật ra.
PT: \(Cu+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+2Ag\)
a, m AgNO3 (pư) = 250.17%.6% = 2,55 (g)
\(\Rightarrow n_{AgNO_3\left(pư\right)}=\dfrac{2,55}{170}=0,015\left(mol\right)\)
Theo PT: nCu (pư) = 1/2nAgNO3 = 0,0075 (mol)
nAg = nAgNO3 = 0,015 (mol)
⇒ m vật lấy ra = 50 - mCu (pư) - mAg = 51,14 (g)
b, Ta có: m dd sau pư = 0,0075.64 + 250 - 0,015.108 = 248,86 (g)
Theo PT: nCu(NO3)2 = 1/2nAgNO3 = 0,0075 (mol)
\(\Rightarrow C\%_{Cu\left(NO_3\right)_2}=\dfrac{0,0075.188}{248,86}.100\%\approx0,57\%\)
\(C\%_{AgNO_3}=\dfrac{250.6\%-2,55}{248,86}.100\%\approx5\%\)
Đúng 1
Bình luận (0)
Ngâm một thanh kim loại bằng đồng có khối lượng 10gam trong 250 gam dung dịch 4%. Khi lấy vật ra khỏi dd thì khối lượng AgNO3 trong dung dịch giảm 17%. Khối lựợng của thanh kim loại sau phản ứng là? A. 10,76 g B. 10,67 g C. 9,67 g D. 9,76 g
Đọc tiếp
Ngâm một thanh kim loại bằng đồng có khối lượng 10gam trong 250 gam dung dịch 4%. Khi lấy vật ra khỏi dd thì khối lượng AgNO3 trong dung dịch giảm 17%. Khối lựợng của thanh kim loại sau phản ứng là?
A. 10,76 g
B. 10,67 g
C. 9,67 g
D. 9,76 g
Bài 6: Ngâm một thanh kim loại bằng đồng có khối lượng 10gam trong 250 gam dung dịch AgNO3 4%. Khi lấy vật ra khỏi dd thì khối lượng dung dịch AgNO3 giảm 0,76 gam. Khối lựợng của thanh kim loại sau phản ứng là?
Khối lượng AgNO3 = 250.4/100 = 10 (g)
Khối lượng AgNO3 trong dung dịch giảm 17% = khối lượng AgNO3 phản ứng = 1,7 (g)
⇒ Số mol AgNO3 = 0,01 mol
Phương trình phản ứng:
Khối lượng vật bằng Cu = 10 - 0,005.64 + 0,01.108 = 10,76 (g)
*Tk
Đúng 2
Bình luận (0)
Ngâm một vật bằng đồng có khối lượng 50gam vào 250 gam dung dịch AgNO3 6% khi Lấy vật ra thấy khối lượng AgNO3 trong dung dịch giảm 17%
a) Hãy xác định khối lượng của vật lấy ra sau phản ứng biết Ag sinh ra Bám vào vật
b) tính nồng độ phần trăm của chất có trong dung dịch sau phản ứng
a./ Khối lượng AgNO3 trong dd ban đầu: m(AgNO3) = 250.6% = 15g
Khối lượng AgNO3 pư: m(AgNO3 pư) = 17%.15 = 2,55g
→ n(AgNO3) = 2,55/170 = 0,015mol
2AgNO3 + Cu → 2Ag + Cu(NO3)2
0,015___0,0075_0,015__0,0075
Khối lượng của vật lấy ra sau pư:
m = 50 + m(Ag) - m(Cu pư) = 50 + 0,015.108 - 0,0075.64 = 51,14g
b./ Khối lượng các chất có trong dd sau pư:
m[Cu(NO3)2] = 0,0075.188 = 1,41g
m(AgNo3 dư) = m(AgNO3) - m(AgNO3 pư) = 15 - 2,55 = 12,45g
Khối lượng dd thu được:
m(dd) = m(dd AgNO3) + m(Cu pư) - m(Ag) = 250 + 0,0075.64 - 0,015.108 = 248,86g
Thành phần % các chất có trong dung dịch
%AgNO3 dư = 12,45/248,86 .100% = 5%
%Cu(NO3)2 = 1,41/248,86 .100% = 0,57%
Đúng 1
Bình luận (0)
Ngâm một vật bằng đồng có khối lượng 10g trong 250g dung dịch AgNO3 4% khi lấy vật ra thì khối lượng AgNO3 trong dung dịch giảm 17%. Xác định khối lượng của vật sau phản ứng.
Khối lượng vật sau phản ứng = 10 + 0,01 x 108 – 0,005 x 64 = 10,76 g
Đúng 0
Bình luận (0)
Ngâm một vật bằng đồng có khối lượng 12g trong 250g dung dịch AgNO3 4% . Khi lấy vật ra thì lượng AgNO3 trong dung dịch giảm 17% . Khối lượng của vật sau phản ứng là (Cu = 64, Ag = 108, N = 14, O = 16)
A. 12,76 gam.
B. 10,76 gam.
C. 12,67 gam.
D. 10,67 gam.
\(n_{AgNO_3}=\dfrac{250.4}{100.170}=\dfrac{1}{17}\left(mol\right)\)
=> \(n_{AgNO_3\left(pư\right)}=\dfrac{1}{17}.17\%=0,01\left(mol\right)\)
PTHH: Cu + 2AgNO3 --> Cu(NO3)2 + 2Ag
____0,005<--0,01--------------------->0,01
=> m = 12 - 0,005.64 + 0,01.108 = 12,76(g)
=> A
Đúng 1
Bình luận (0)
Ngâm một vật bằng đồng có khối lượng 10g trong 250g dung dịch AgNO3 4% khi lấy vật ra thì khối lượng AgNO3 trong dung dịch giảm 17%.
Viết phương trình hóa học của phản ứng và cho biết vai trò các chất tham gia phản ứng.
2AgNO3 + Cu → Cu(NO3)2 + 2Ag
Phương trình ion thu gọn: Cu + 2Ag+ → Cu2+ + 2Ag↓
AgNO3 là chất oxi hóa, Cu là chất khử.
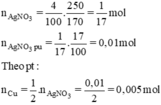
Áp dụng tăng giảm khối lượng
Đúng 0
Bình luận (0)
Ngâm một vật bằng đồng có khối lượng 5g trong 250 g dung dịch AgNO3 8% chỉ sau một thời gian ngắn Lấy vật ra và kiểm tra thấy khối lượng AgNO3 trong dung dịch bắt đầu giảm 85%
a) tính khối lượng vật lý ra sao Khi lau khô
b) tính nồng độ phần trăm của các chất hòa tan trong dung dịch phản ứng sau khi Lấy vật ra
Khối lương AgNO3 = 250.4/100 = 10 gam; khối lượng AgNO3 giảm 17% có nghĩa là giảm 10.17/100 = 1,7 gam ---> số mol AgNO3 = 1,7/170 = 0,01 mol (tham gia phản ứng)
Cu + 2AgNO3 ------> Cu(NO3)2 + 2Ag
0,005 0,01 0,01
Khối lượng thanh Cu tăng thêm: 0,01.108 - 0,005.64 = 0,76 gam
Khối lượng vật sau pu là 10,76 gam
(Cứ tan ra 0,32 gam đồng thì sinh ra 1,08 gam Ag bám vào vật bằng Cu do đó vật tăng 10 + 0,76 gam)
Đúng 0
Bình luận (1)

















