Một kim loại R tạo muối R(NO3)3. xác định CTHH muối sunfat cuar kim loại R

Những câu hỏi liên quan
hoà tan một muối cacbonat của kim loại R ( chưa biết hoá trị ) trong một lượng vừa đủ dung dịch H2SO4 12,25% thu được dung dịch muối sunfat của kim loại R có nồng độ 17,431%. Xác định kim loại R
tham khảo
Coi mdd H2SO4=100(gam)mdd H2SO4=100(gam)
nR2(SO4)n=nR2(CO3)n=nH2SO4n=0,1n(mol)nR2(SO4)n=nR2(CO3)n=nH2SO4n=0,1n(mol)
Sau phản ứng ,
mR2(SO4)n=0,1n(2R+96n)=0,2Rn+9,6(gam)mR2(SO4)n=0,1n(2R+96n)=0,2Rn+9,6(gam)
Đúng 0
Bình luận (0)
một kim loại R tạo muối sunfat R2(SO4)3.tÌm công thức hoá học của muối nitrat của kim loẠI R
tớ thì trình bày theo cách nghĩ của tớ nha
biết SO4 hóa trị II
-> Ra 2 (SO4)II 3 -> a = 3 .II trên 2 = 3
-> hóa trị của R là III
TA CÓ : biết nitrat kí hiệu là NO ; R hóa trị là III
ta có công thức sau : ( NO) 3 R ( chỗ tìm NO thì cx giống vs tìm R nha )
Đúng 0
Bình luận (0)
một kim loại R tạo muối sunfat có dạng R2(SO4)3 .TÌM công thức hoá học muối nitrat của kim loại R
Gọi hóa trị của R là a
Nhóm SO4 có hóa trị II
Theo quy tắc hóa trị:
\(a\times2=II\times3\)
\(\Leftrightarrow2a=6\)
\(\Leftrightarrow a=3\)
Vậy R có hóa trị III
Gọi CTHH của muối nitrat là Rx(NO3)y
Nhóm NO3 có hóa trị I
Theo quy tắc hóa trị:
\(x\times III=y\times I\)
\(\Rightarrow\dfrac{x}{y}=\dfrac{I}{III}=\dfrac{1}{3}\left(tốigiản\right)\)
Vậy \(x=1;y=3\)
Vậy CTHH của muối nitrat là R(NO3)3
Đúng 0
Bình luận (0)
một muối sunfat (sunfat SO4) của kim loại hóa trị 2 có tỉ lệ về khối lượng giữa kim loại và gốc axit là 7/12 Hãy xác định CTHH của muối trên
M(X)/M(SO4)=7/12
<=>M(X)/96=7/12
=>M(X)=(96.7)/12=56
=>X là sắt (Fe=56)
=>CTHH muối: FeSO4 (muối sắt (II) sunfat
Đúng 2
Bình luận (0)
Hòa tan hết 32g oxit của một kim loại R có hóa trị III trong 294g dung dịch H2SO4 20% a)Xác định công thức của oxit kim loại b) tính khối lượng muối sunfat thu được
a) CTHH: R2O3
\(m_{H_2SO_4}=\dfrac{294.20}{100}=58,8\left(g\right)=>n_{H_2SO_4}=\dfrac{58,8}{98}=0,6\left(mol\right)\)
PTHH: R2O3 + 3H2SO4 --> R2(SO4)3 + 3H2O
_______0,2<------0,6---------->0,2_________________(mol)
=> \(M_{R_2O_3}=\dfrac{32}{0,2}=160\left(g/mol\right)=>M_R=56\left(Fe\right)\)
b) \(m_{Fe_2\left(SO_4\right)_3}=0,2.400=80\left(g\right)\)
Đúng 3
Bình luận (0)
Kim loại R tạo ra 2 muối RCln và RClm biết clorua ở mức hóa trị thấp Cl chiếm 55,91% về khối lượng , muối clorua ở mức hóa trị cao Cl chiếm 65,539% về khối lượng . Xác định kim loại R
Giả sử n < m
- Với RCln: \(\%Cl=\dfrac{35,5n}{M_R+35,5n}.100\%=55,91\%\)
=> MR = 28n (g/mol)
- Với RClm: \(\%Cl=\dfrac{35,5m}{M_R+35,5m}.100\%=65,539\%\)
=> MR = 18,66m (g/mol)
TH1: n = 1 => MR = 28 => Loại
TH2: n = 2 => MR = 56 (g/mol) => R là Fe => m = 3 (thỏa mãn)
Đúng 3
Bình luận (0)
Thế gọi n là hoá trị thấp, m là hoá trị cao. (m,n:nguyên, dương)
\(\Rightarrow\left\{{}\begin{matrix}\dfrac{35,5n}{M_R+35,5n}.100\%=55,91\%\\\dfrac{35,5m}{M_R+35,5m}.100\%=65,539\%\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}\dfrac{M_R}{35,5n}=\dfrac{44,09\%}{55,91\%}=0,789\\\dfrac{M_R}{35,5m}=\dfrac{34,461\%}{65,539\%}=0,526\end{matrix}\right.\)
Xét các giá trị từ 1 đến 3 (m>n) ta nhận giá trị n=2 và m=3 => MR=56(g/mol)
=> R là Sắt (Fe=56)
Đúng 2
Bình luận (0)
Mừng năm mới 2022!
Chúc mọi người một năm vui vẻ, bình an, nhiều thành công trong công việc và cuộc sống
Đúng 0
Bình luận (5)
Cho 10,8g một kim loại R có hoá trị III tác dụng với khí cl2 dư thu đc 53,4 g muối. Xác định kim loại R.
$2R + 3Cl_2 \xrightarrow{t^o} 2RCl_3$
Theo PTHH :
$n_R = n_{RCl_3} \Rightarrow \dfrac{10,8}{R} = \dfrac{53,4}{R + 35,5.3}$
$\Rightarrow R = 27(Al)$
Đúng 0
Bình luận (0)
Một kim loại M tạo muối sunfat có dang M 2 ( S O 4 ) 3 . Hãy xác định công thức muói nitrat của kim loại M.
cho 2,5g kim loại R ( hóa trị II) tác dụng với dung dịch H2SO4 loãng thấy giải phóng 2,24l ở đktc và tạo ra muối ( RSO4). Hãy xác định kim loại R
Tính được : \(n_{H2}=0,1\left(mol\right)\)
PTHH :
\(R+H_2SO_4\rightarrow RSO_4+H_2\)
\(1..1...........1........1\)
\(0,1......0,1..........0,1.........0,1\)
\(M_R=\frac{M_R}{M_R}=\frac{2,5}{0,1}=25\) ( g/mol )
Vậy \(R=25\)
Đúng 0
Bình luận (0)
R + H2SO4 ---> RSO4 + H2
nH2 = \(\dfrac{2,24}{22,4}\) = 0,1 mol
TPT : nR = nH2
=> nR = 0,1 mol
=> \(M_R\) = \(\dfrac{2,5}{0,1}\) = 25 đvC
Hình như sai đề bài
Đúng 0
Bình luận (0)
PƯHH:R+H2SO4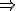 RSO4+H2
RSO4+H2
Ta có:nH2=2,24:22,4=0,1(mol)
Ta lại có:
1 mol R tạo thành 1 mol H2
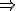 x mol R tạo thành 0,1 mol H2
x mol R tạo thành 0,1 mol H2
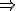 x=0,1(mol)
x=0,1(mol)
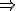 MR=mR:nR=2,5:0,1=25g
MR=mR:nR=2,5:0,1=25g
 không xác định
không xác định
Đúng 0
Bình luận (0)

























