Sục từ từ 3.36l so2 vào 200ml dd koh 2m tính m

Những câu hỏi liên quan
sục V lít khí CO2 đkc vào dd NaOH thu được 200ml dd X. cho từ từ đến hết 200ml dd X vào 150ml dd HCl 1.5M và H2SO4 1M thoát ra 6.72l khí CO2 đkc. cho BaCl2 dư vài dd sau phản ứng thu được 49.725g kết tủa. v =???
giả sử kết tủa chỉ có BaSO4 => mBaSO4 =0,15 .233 =34,95 < 49,725 => kết tủa gồm BaCO3 và BaSO4
giả sử trong dd X chỉ có muối CO3 2- => nH+ = 0,3 .2 =0,6 > 0,525 => loại
trong dd X chỉ có HCO3- => nH+ = 0,3 => loại
vậy trong X có cả 2 muối trên
mBaCO3 =m kết tủa - mBaSO4 => nBaCO3 = 0,075
nCO2 =0,075 + 0,3 =0,375 => V=8,4
Đúng 0
Bình luận (0)
Tiến hành 2 TN sau:
TN 1: Cho từ từ 235,2g dd H3PO4 5% vào dd chứa 200ml dd NaOH 1M (D= 1,2g/ml)
TN 2: Cho từ từ 200g dd NaOH 4% vào 117,6 g dd H3PO4 10%
a) Giải thích quá trình thí nghiệm bằng phản ứng hóa học
b) Tính khối lượng muối tạo thành ?và nồng độ% của chúng?
1/ Cho 100ml dd NaOH 0,2M tác dụng với 250ml dd H2SO4 1M được dd A. Cho dd A tác dụng với dd BaCl2 12% .Hãy tính khối lượng kết tủa tạo thành và khối lượng dd BaCl2 càn dùng2/Đổ từ từ 200ml dd H2SO4 4,5M vào để trung hòa 400ml dd NaOH 3M. Tính:a)khối lượng mỗi muối thu được sau phản ứngb) để tác dụng hết với dd thu được sau phản ứng đó cần dùng bao nhiêu ml dd BaCl2 2M
Đọc tiếp
1/ Cho 100ml dd NaOH 0,2M tác dụng với 250ml dd H2SO4 1M được dd A. Cho dd A tác dụng với dd BaCl2 12% .Hãy tính khối lượng kết tủa tạo thành và khối lượng dd BaCl2 càn dùng
2/Đổ từ từ 200ml dd H2SO4 4,5M vào để trung hòa 400ml dd NaOH 3M. Tính:
a)khối lượng mỗi muối thu được sau phản ứng
b) để tác dụng hết với dd thu được sau phản ứng đó cần dùng bao nhiêu ml dd BaCl2 2M
Mấy bài này viết PTHH rồi tìm chất nào dư chất nào hết thôi nhé!
Đúng 0
Bình luận (1)
1.\(n_{NaOH}=0,1.0,2=0,02\left(mol\right)\)
\(n_{H_2SO_4}=0,25.1=0,25\left(mol\right)\)
2NaOH + H2SO4 → Na2SO4 + 2H2O
Lập tỉ lệ NaOH và H2SO4 : \(\dfrac{0,02}{2}< \dfrac{0,25}{1}\)
=> H2SO4 dư, NaOH hết
Na2SO4 + BaCl2 → BaSO4 + 2NaCl
H2SO4 + BaCl2 → BaSO4 + 2HCl
\(n_{Na_2SO_4}=\dfrac{1}{2}n_{NaOH}=0,01\left(mol\right)\)
\(n_{H_2SO_4\left(dư\right)}=0,25-0,01=0,24\left(mol\right)\)
=> \(n_{BaSO_4}=0,01+0,24=0,25\left(mol\right)\)
=> \(m_{BaSO_4}=0,25.233=58,25\left(g\right)\)
=> \(m_{ddBaCl_2}=\dfrac{\left(0,01+0,24\right).208}{12\%}=433,33\left(g\right)\)
Đúng 1
Bình luận (0)
Nung
C
a
C
O
3
thu được V1 l khí. Sục khí vào 200ml dd
B
a
O
H
2
0.5M được 3.94 g kết tủa. Tính khối lượng muối ban đầu? A. 7g B. 2g hoặc 18 g C. 9g D. 10g
Đọc tiếp
Nung C a C O 3 thu được V1 l khí. Sục khí vào 200ml dd B a O H 2 0.5M được 3.94 g kết tủa. Tính khối lượng muối ban đầu?
A. 7g
B. 2g hoặc 18 g
C. 9g
D. 10g
n B a C O 3 = 3,94/197 = 0,02mol
n B a O H 2 = 0,5.0,2 = 0,1 mol
C a C O 3 → t 0 C a O + C O 2 ( 1 )
Sục khí C O 2 vào B a O H 2 , theo bài ra có thể xảy ra các trường hợp sau:
TH1: C O 2 thiếu, B a O H 2 dư.
⇒ n C O 2 = n B a C O 3 = 0,02 mol
⇒ n C a C O 3 = n C O 2 = 0,02 mol
⇒ m = 0,02.100 = 2g
TH2: Cả 2 cùng hết , tạo 2 muối.
B a O H 2 + C O 2 → B a C O 3 + H 2 O 1 0 , 02 ← 0 , 02 ← 0 , 02 m o l
B a O H 2 + 2 C O 2 → B a H C O 3 2 2 ( 0 , 1 – 0 , 02 ) → 0 , 08 . 2 m o l
Từ (1) ⇒ n C O 2 = 0 , 02 + 0 , 08 = 0 , 18 m o l
⇒ n C a C O 3
⇒ m C a C O 3 = 18 g
⇒ Chọn B.
Đúng 0
Bình luận (0)
Cho 4,48l khí SO2 đi từ từ qua 200g dung dịch KOH 1,12% đến khi p/ứ hoàn thành thu được dung dịch X .Tính nồng đọ % chất tan trong X (Tính theo tỉ lệ T)
Theo gt ta có: $n_{SO_2}=0,2(mol);n_{KOH}=0,04(mol)$
$KOH+SO_2\rightarrow KHSO_3$
Ta có: $n_{KHSO_3}=0,04(mol)$
$\Rightarrow \%C_{KHSO_3}=2,26\%$
Đúng 2
Bình luận (0)
Ta có: \(n_{SO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(m_{KOH}=200.1,12\%=2,24\left(g\right)\Rightarrow n_{KOH}=\dfrac{2,24}{56}=0,04\left(mol\right)\)
\(\Rightarrow\dfrac{n_{KOH}}{n_{SO_2}}=0,2< 1\)
Vậy: Pư tạo muối KHSO3.
PT: \(SO_2+KOH\rightarrow KHSO_3\)
__________0,04______0,04 (mol)
Có: m dd sau pư = 0,2.64 + 200 = 212,8 (g)
\(\Rightarrow C\%_{KHSO_3}=\dfrac{0,04.120}{212,8}.100\%\approx2,26\%\)
Bạn tham khảo nhé!
Đúng 2
Bình luận (0)
kHòa tan 12,6 gam hỗn hơ X gồm Al và Mg trong dd HNO3 12,6% đủ thu được 8,96 lít khí NO là sản phẩm khử duy nhất đktc và dd Y . Nếu cho từ từ hỗn hợp dd B gồm KOH 1M và Ba(OH)2 0,5M vào dd Y đến khi lượng kết tủa không đổi . tính thể tích tối thiểu dd B đã dùng
Thêm từ từ nước vào 210g dd axit sunfuric 30% thì được dd axit 15%
a) Tính số ml nước đã thêm vào
b) Nếu lấy lượng dd axit 30% trên hòa thêm vào 40g lưu huỳnh trioxit thì thu được dd axit mấy % và mấy M?
Biết 1ml dd sau khi thêm có khối lượng 1,25g
\(m_{H_2SO_4\left(trươc\right)}=\dfrac{30.210}{100}=63\left(g\right)\)
Vì sau khi thêm nước vào dung dich thì khối lượng H2SO4 có troing dung dich không bị thay đổi
\(\Rightarrow m_{H_2SO_4\left(sau\right)}=m_{H_2SO_4\left(trươc\right)}=63\left(g\right)\)
Gọi x là khối lượng nước đã thêm.
\(\Rightarrow m_{ddH_2SO_4\left(sau\right)}=x+210\left(g\right)\)
Ta có: \(15=\dfrac{63.100}{x+210}\)
\(\Rightarrow x=210\left(g\right)\)
\(\Rightarrow\)Khối lượng nước đã thêm là: \(210(g)\)
\(\Rightarrow nH_2O=\dfrac{35}{3}\left(mol\right)\)
\(\Rightarrow V_{H_2O}=261,333\left(l\right)=261333\left(ml\right)\)
Khi lấy lượng dd axit 30% trên hòa thêm vào 40g lưu huỳnh trioxit thì
\(SO_3(0,5)+H_2O--->H_2SO_4(0,5)\)
\(nSO_3=\dfrac{40}{80}=0,5\left(mol\right)\)
Theo PTHH: \(nH_2SO_4=0,25(mol)\)
\(\Rightarrow m_{H_2SO_4\left(saukhithem\right)}=63+0,25.98=87,5\left(g\right)\)
\(m_{ddH_2SO_4\left(saukhithem\right)}=m_{SO_3}+m_{ddH_2SO_4\left(bandau\right)}=40+210=250\left(g\right)\)
\(\Rightarrow C\%H_2SO_4\left(saukhithem\right)=\dfrac{87,5}{250}.100\%=35\%\)
Theo đề, 1ml dd sau khi thêm có khối lượng 1,25g
\(\Rightarrow D_{H_2SO_4}=1,25\)\((g/ml)\)
\(\Rightarrow C_{M_{H_2SO_4}}\left(saukhithem\right)=\dfrac{10.C\%_{H_2SO_4}.D_{H_2SO_4}}{M_{H_2SO_4}}=\dfrac{10.35.1,25}{98}=4,464\left(M\right)\)
Đúng 0
Bình luận (0)
Cho 18.5 gam hỗn hợp X gồm Fe, Zn, Cu vào dung dịch H2SO4 loãng dư thu được 4,48 lit khí (dktc). Nếu cũng cho lượng hỗn hợp X trên vào H2SO4 đặc nóng, eư thì thu được 7,84 lit khí SO2 (dktc)a) Tính thành phần trăm theo khối lượng của các kim loại trong hỗn hợp đầub) Dẫn lượng khí So2 thu được đi qua 200ml dd KOH 1M. Tính khối lượng và nồng độ mol các chất trong dd sau phản ứng
Đọc tiếp
Cho 18.5 gam hỗn hợp X gồm Fe, Zn, Cu vào dung dịch H2SO4 loãng dư thu được 4,48 lit khí (dktc). Nếu cũng cho lượng hỗn hợp X trên vào H2SO4 đặc nóng, eư thì thu được 7,84 lit khí SO2 (dktc)
a) Tính thành phần trăm theo khối lượng của các kim loại trong hỗn hợp đầu
b) Dẫn lượng khí So2 thu được đi qua 200ml dd KOH 1M. Tính khối lượng và nồng độ mol các chất trong dd sau phản ứng
Tiến hành thí nghiệm như hình vẽ: Ban đầu trong cốc chứa nước vôi trong. Sục rất từ từ khí CO2 vào cốc cho tới dư. Hỏi độ sáng của bóng đèn thay đổi như thế nào? A. Tăng dần rồi giảm dần đến tắt. B. Giảm dần đến tắt rồi lại sáng tăng dần. C. Tăng dần. D. Giảm dần đến tắt.
Đọc tiếp
Tiến hành thí nghiệm như hình vẽ:
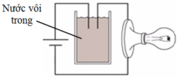
Ban đầu trong cốc chứa nước vôi trong. Sục rất từ từ khí CO2 vào cốc cho tới dư. Hỏi độ sáng của bóng đèn thay đổi như thế nào?
A. Tăng dần rồi giảm dần đến tắt.
B. Giảm dần đến tắt rồi lại sáng tăng dần.
C. Tăng dần.
D. Giảm dần đến tắt.




















