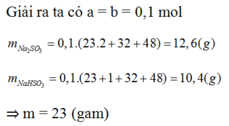hoà 150ml NaCl 2M vào 150ml AgNO3 3M tính CM của dung dịch thu được

Những câu hỏi liên quan
Cho 100ml dung dịch NaCl 0,1M vào 150ml dung dịch AgNO3 0,1M. Tính nồng đọ mol các ion trong dung dịch thu được
\(n_{NaCl}=0.1\cdot0.1=0.01\left(mol\right)\)
\(n_{AgNO_3}=0.15\cdot0.1=0.015\left(mol\right)\)
\(NaCl+AgNO_3\rightarrow NaNO_3+AgCl\)
\(0.01..........0.01...............0.01\)
Dung dịch : 0.01 (mol) NaNO3 , 0.005 (mol) AgNO3
\(\left[Na^+\right]=\dfrac{0.01}{0.1+0.15}=0.04\left(M\right)\)
\(\left[Ag^+\right]=\dfrac{0.005}{0.25}=0.02\left(M\right)\)
\(\left[NO_3^-\right]=\dfrac{0.01+0.005}{0.25}=0.06\left(M\right)\)
Đúng 2
Bình luận (0)
cho 2,24 lít khí H2S vào 150ml dung dịch KOH 2m. Tính nồng độ các chất thu được
nKOH = 0,15 . 2 = 0,3 (mol)
nH2S = 2,24/22,4 = 0,1 (mol)
PTHH: 2KOH + H2S -> K2S + 2H2O
LTL: 0,3/2 > 0,1 => KOH dư
nKOH (p/ư) = 0,1 . 2 = 0,2 (mol)
nKOH (dư) = 0,3 - 0,2 = 0,1 (mol)
nK2S = 0,1 (mol)
CMK2S = 0,1/0,15 = 0,66M
CMKOH = 0,1/0,15 = 0,66M
Đúng 2
Bình luận (0)
trộn 50ml dung dịch có chứa 11,7g nacl với 150ml dung dịch có chứa 25,5g agno3
a tính khối lượng kết tủa tạo thành
b tính Cm trong dung dịch phản ứng ( voi thể tích dung dịch ko đáng kể)
50ml = 0,05l
150ml =0,15l
\(n_{NaCl}=\dfrac{11,7}{58,5}=0,2\left(mol\right)\)
\(n_{AgNO3}=\dfrac{25,5}{170}=0,15\left(mol\right)\)
Pt : \(NaCl+AgNO_3\rightarrow NaNO_3+AgCl|\)
1 1 1 1
0,2 0,15 0,15 0,15
a) Lập tỉ số so sánh : \(\dfrac{0,2}{1}>\dfrac{0,15}{1}\)
⇒ NaCl dư , AgNO3 phản ứng hết
⇒ Tính toán dựa vào số mol của AgNO3
\(n_{AgCl}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
⇒ \(m_{AgCl}=0,15.143,5=21,525\left(g\right)\)
b) \(n_{NaNO3}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
\(n_{NaCl\left(dư\right)}=0,2-0,15=0,05\left(mol\right)\)
\(V_{ddspu}=0,05+0,15=0,2\left(l\right)\)
\(C_{M_{NaNO3}}=\dfrac{0,15}{0,2}=0,75\left(M\right)\)
\(C_{M_{NaCl\left(dư\right)}}=\dfrac{0,05}{0,2}=0,25\left(M\right)\)
Chúc bạn học tốt
Đúng 0
Bình luận (0)
Hấp thụ 4,48 lít SO2 (đktc) vào 150ml dung dịch NaOH 2M, thu được dung dịch chứa m gam muối. Giá trị của m là:
A. 18,9
B. 25,2
C. 20,8
D. 23,0
Hấp thụ 4,48l SO2 (đktc) vào 150ml dung dịch NaOH 2M thu đc dung dịch chứ m gam muối tính m
\(n_{SO_2}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(n_{NaOH}=0.15\cdot2=0.3\left(mol\right)\)
\(T=\dfrac{0.3}{0.2}=1.5\)
=> Tạo ra 2 muối
\(n_{Na_2SO_3}=a\left(mol\right),n_{NaHSO_3}=b\left(mol\right)\)
\(2NaOH+SO_2\rightarrow Na_2SO_3+H_2O\)
\(NaOH+SO_2\rightarrow NaHSO_3\)
\(\left\{{}\begin{matrix}2a+b=0.3\\a+b=0.2\end{matrix}\right.\)
\(\Rightarrow a=b=0.1\)
\(m_{Muối}=0.1\cdot126+0.1\cdot104=23\left(g\right)\)
Đúng 2
Bình luận (0)
$n_{SO_2} = 0,2(mol) ; n_{NaOH} = 0,3(mol)$
$1 < \dfrac{n_{NaOH}}{n_{SO_2}} = 1,5 < 2$ nên muối gồm $Na_2SO_3(a\ mol) ; NaHSO_3(b\ mol)$
$2NaOH + SO_2 \to Na_2SO_3 + H_2O$
$NaOH + SO_2 \to NaHSO_3$
Theo PTHH :
$n_{NaOH} = 2a + b = 0,3$
$n_{SO_2} = a + b = 0,2$
Suy ra: a = b = 0,1
Vậy :
$m = 0,1.126 + 0,1.104 = 23(gam)$
Đúng 2
Bình luận (0)
Số mol của khí sunfuro
nSO2 = \(\dfrac{V_{SO2}}{22,4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
150ml = 0,15l
Số mol của dung dịch natri hidroxit
CMNaOH = \(\dfrac{n}{V}\Rightarrow n=C_M.V=2.0,15=0,3\left(mol\right)\)
Pt : SO2 + 2NaOH → Na2SO3 + H2O\(|\)
1 2 1 1
0,2 0,3 0,2
Lập tỉ số so sánh : \(\dfrac{0,2}{1}< \dfrac{0,3}{2}\)
⇒ SO2 phản ứng hết , NaOH dư
⇒ Tính toán dựa vào số mol SO2
Số mol của muối natri sunfit
nNa2SO3 = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Khối lượng của muối natri sunfit
mNa2SO3 = nNaSO3 . MNa2SO3
= 0,2 . 126
= 25,2 (g)
Chúc bạn học tốt
Đúng 2
Bình luận (0)
Xem thêm câu trả lời
Dẫn 3,36 lít khí CO2 qua 150ml dụng dịch NaOH 3M. Tính nồng độ mol dung dịch thu được.
Ta có: \(n_{CO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_{NaOH}=0,15.3=0,45\left(mol\right)\)
\(\Rightarrow\dfrac{n_{NaOH}}{n_{CO_2}}=\dfrac{0,45}{0,15}=3\)
→ Pư tạo Na2CO3 và NaOH dư.
PT: \(CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\)
______0,15_____0,3_______0,15 (mol)
nNaOH (dư) = 0,45 - 0,3 = 0,15 (mol)
\(\Rightarrow C_{M_{NaOH}}=C_{M_{Na_2CO_3}}=\dfrac{0,15}{0,15}=1\left(M\right)\)
Đúng 1
Bình luận (0)
Cho 11,2(g) sắt vào 150ml dung dịch H2SO4 2M a, tính VH2(đktc) thu được và MFeSO4 tạo thành b, tính nồng độ mol/l của chất tan trong dung dịch sau PƯ(coi thể tích dung dịch thay đổi kh đáng kể
\(n_{Fe}=\dfrac{11,2}{56}=0,2mol\)
\(n_{H_2SO_4}=0,15.2=0,3mol\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,2 < 0,3 ( mol )
0,2 0,2 0,2 0,2 ( mol )
\(V_{H_2}=0,2.22,4=4,48l\)
\(m_{FeSO_4}=0,2.152=30,4g\)
\(\left\{{}\begin{matrix}C_{M_{FeSO_4}}=\dfrac{0,2}{0,15}=1,33M\\C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0,3-0,2}{0,15}=0,67M\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Trộn 150ml dung dịch HCl 10% có khối lượng riêng D=1,206 g/ml với 250 ml dung dịch HCl 2M thu được dung dịch A . Tính nồng độ mol của dung dịch A
\(m_{dd_{HCl\left(10\%\right)}}=150\cdot1.206=180.9\left(g\right)\)
\(n_{HCl}=\dfrac{180.9\cdot10\%}{36.5}\approx0.5\left(mol\right)\)
\(n_{HCl\left(2M\right)}=0.25\cdot2=0.5\left(mol\right)\)
\(n_{HCl}=0.5+0.5=1\left(mol\right)\)
\(V_{dd_{HCl}}=150+250=400\left(ml\right)=0.4\left(l\right)\)
\(C_{M_{HCl}}=\dfrac{1}{0.4}=2.5\left(M\right)\)
Đúng 4
Bình luận (0)
Tính nồng độ của hai dung dịch axit clohiđric trong các trường hợp sau:
a) Cần phải dùng 150ml dung dịch HCl để kết tủa hoàn toàn 200g dung dịch AgNO3 8,5%.
b) Khi cho 50g dung dịch HCl vào một cốc đựng NaHCO3 (dư) thì thu được 2,24 lít khí ở đktc.
a) 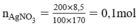
Phương trình hóa học của phản ứng:
HCl + AgNO3 → AgCl + HNO3
Theo pt nHCl = nAgCl = 0,1 mol
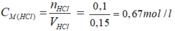
b) 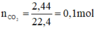
Phương trình hóa học của phản ứng:
HCl + NaHCO3 → NaCl + CO2↑ + H2O
Theo pt: nHCl = nCO2 = 0,1 mol ⇒ mHCl = 0,1. 36,5 = 3,65 g
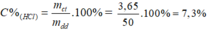
Đúng 0
Bình luận (0)