Cho hai mảnh Mg cùng khối lượng vào hai ống nghiệm chứa cùng thể tích dung dịch HCl dư, nồng độ dung dịch HCl ở ống nghiệm (a) và (b) lần lượt là 2M và 0,5M. Hiện tượng thí nghiệm được mô tả như hình 16.1. Theo em, dây Mg ở ống nghiệm nào sẽ bị tan hết trước? Giải thích.
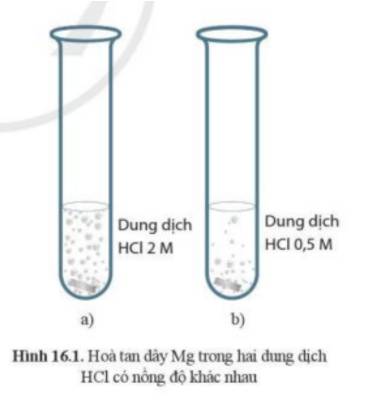

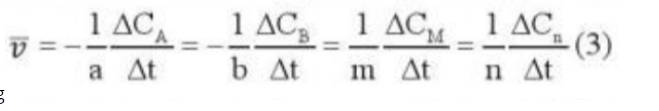
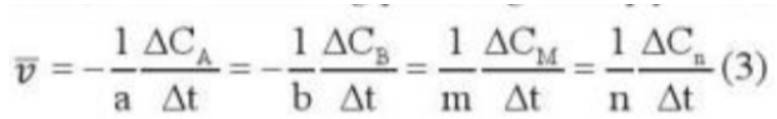

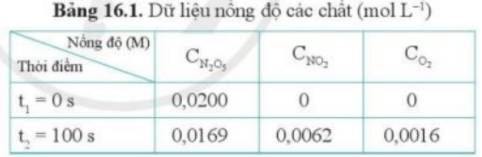
- Ở ống nghiệm (a) có hiện tượng sủi bọt khí nhiều hơn
=> Phản ứng ở ống nghiệm (a) xảy ra mãnh liệt hơn
=> Dây Mg ở ống nghiệm (a) sẽ bị tan hết trước
Mg + 2HCl → MgCl2 + H2↑
Trả lời bởi Hà Quang Minh