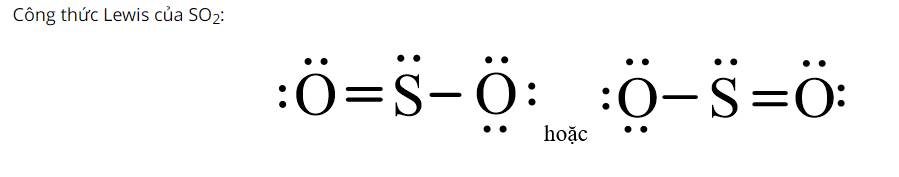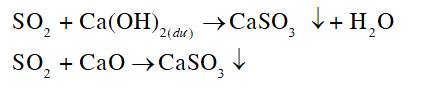Việc lạm dụng sulfur để bảo quản dược liệu, thực phẩm khô,… có thể gây hại đến sức khỏe. Vì sao?
Bài 6. Sulfur và sulfur dioxide
Mở đầu (SGK Cánh Diều trang 39)
Thảo luận (1)
Câu hỏi 1 (SGK Cánh Diều trang 40)
Trong tự nhiên, nguyên tố sulfur tồn tại ở dạng hợp chất dễ tan hay khó tan trong nước?
Thảo luận (1)Hướng dẫn giảiPhần lớn sulfur tồn tại ở dạng hợp chất trong thành phần của các khoáng vật, như pyrite (thành phần chính là FeS2), sphalerite (thành phần chính là ZnS), thạch cao (thành phần chính là CaSO4), barite (thành phần chính là BaSO4),... Ngoài ra, sulfur còn có trong thành phần của một số protein động vật, thực vật.
Các hợp chất trên đều là các hợp chất khó tan trong nước.
(Trả lời bởi Quoc Tran Anh Le)
Thí nghiệm 1 (SGK Cánh Diều trang 40)
Thí nghiệm 1. Tính oxi hoá của sulfurChuẩn bị: Bột sulfur, bột sắt, giấy lọc, ống nghiệm chịu nhiệt, đũa thuỷ tinh, đèn cồn, giá thí nghiệm.Tiến hành: Trộn đều hỗn hợp gồm khoảng 1 gam bột sắt và 0,6 gam bột sulfur trên mảnh giấy lọc. Cho hỗn hợp vào ống nghiệm chịu nhiệt, đặt ống nghiệm lên giá thí nghiệm. Đun nóng ống nghiệm trên ngọn lửa đèn cồn cho đến khi hỗn hợp “chảy” và hoá đen.Yêu cầu: Viết phương trình hoá học của phản ứng đã diễn ra và cho biết vai trò của các chất trong phản ứng.
Đọc tiếp
Thí nghiệm 1. Tính oxi hoá của sulfur
Chuẩn bị: Bột sulfur, bột sắt, giấy lọc, ống nghiệm chịu nhiệt, đũa thuỷ tinh, đèn cồn, giá thí nghiệm.
Tiến hành: Trộn đều hỗn hợp gồm khoảng 1 gam bột sắt và 0,6 gam bột sulfur trên mảnh giấy lọc. Cho hỗn hợp vào ống nghiệm chịu nhiệt, đặt ống nghiệm lên giá thí nghiệm. Đun nóng ống nghiệm trên ngọn lửa đèn cồn cho đến khi hỗn hợp “chảy” và hoá đen.
Yêu cầu: Viết phương trình hoá học của phản ứng đã diễn ra và cho biết vai trò của các chất trong phản ứng.
Thảo luận (1)Hướng dẫn giải
Thí nghiệm 2 (SGK Cánh Diều trang 40)
Thí nghiệm 2. Tính khử của sulfurChuẩn bị: Bột sulfur, giấy quỳ tím, muỗng đốt hoá chất (đã xuyên qua nút cao su), bình tam giác (loại nhỏ) chứa nước và khí oxygen.Tiến hành: Dùng muỗng đốt hóa chất (đã được xuyên qua nút cao su) lấy một ít bột sulfur (khoảng 1/2 muỗng). Đeo khẩu trang. Đốt muỗng chứa sulfur trên ngọn lửa đèn cồn. Khi sulfur cháy thì đưa nhanh muỗng đốt vào bình tam giác chứa sẵn khí oxygen và một ít nước. Đậy kín bình bằng cách di chuyển nhanh nút cao su trên muỗng vào miệng bì...
Đọc tiếp
Thí nghiệm 2. Tính khử của sulfur
Chuẩn bị: Bột sulfur, giấy quỳ tím, muỗng đốt hoá chất (đã xuyên qua nút cao su), bình tam giác (loại nhỏ) chứa nước và khí oxygen.
Tiến hành: Dùng muỗng đốt hóa chất (đã được xuyên qua nút cao su) lấy một ít bột sulfur (khoảng 1/2 muỗng). Đeo khẩu trang. Đốt muỗng chứa sulfur trên ngọn lửa đèn cồn. Khi sulfur cháy thì đưa nhanh muỗng đốt vào bình tam giác chứa sẵn khí oxygen và một ít nước. Đậy kín bình bằng cách di chuyển nhanh nút cao su trên muỗng vào miệng bình. Khi ngọn lửa trong bình đã tắt thì lắc nhẹ bình rồi để yên khoảng 1 phút. Dùng giấy quỳ tím thử pH của dung dịch trong bình tam giác.
Yêu cầu: Viết phương trình hoá học của các phản ứng xảy ra trong quá trình thí nghiệm. Giải thích các hiện tượng quan sát được.
Thảo luận (1)Hướng dẫn giải- Khi đốt lưu huỳnh trong không khí, lưu huỳnh cháy cho ngọn lửa nhỏ màu xanh nhạt, sau đó cho lưu huỳnh cháy trong khí oxygen, cho ngọn lửa lớn hơn màu sáng xanh.
Giải thích: lưu huỳnh cháy mạnh hơn trong khí oxygen tạo sulfur dioxide.
S + O2 → SO2
- Dùng giấy quỳ tím vào dung dịch trong bình tam giác, quỳ tím hóa đỏ.
Giải thích: Khí SO2 là acidic oxide khi tan trong nước tạo ra acid H2SO3 làm quỳ tím hóa đỏ, dung dịch trong bình tam giác có môi trường acid
SO2 + H2O → H2SO3
(Trả lời bởi Quoc Tran Anh Le)
Luyện tập 1 (SGK Cánh Diều trang 40)
Sulfur dioxide thuộc loại acidic oxide. Hãy cho biết sulfur dioxide có phản ứng được với calcium hydroxide, calcium oxide không. Viết phương trình hoá học của phản ứng xảy ra (nếu có).
Thảo luận (1)Hướng dẫn giảiSulfur dioxide thể hiện đầy đủ các tính chất của acidic oxide như phản ứng với nước tạo môi trường acid, phản ứng với basic oxide hoặc base tạo thành muối.
Vậy sulfur dioxide có phản ứng được với calcium hydroxide, calcium oxide. Phương trình hoá học minh hoạ:
SO2 + Ca(OH)2 (dư) → CaSO3 + H2O;
SO2 + CaO → CaSO3.
(Trả lời bởi Quoc Tran Anh Le)
Luyện tập 2 (SGK Cánh Diều trang 40)
Hãy đề nghị công thức Lewis của SO2.
Thảo luận (1)Hướng dẫn giải
Câu hỏi 2 (SGK Cánh Diều trang 42)
Nguyên tử sulfur thể hiện nhiều số oxi hoá khác nhau trong các hợp chất, như -2, +4, +6. Hãy giải thích vì sao SO2 có cả tính khử và tính oxi hoá.
Thảo luận (1)Hướng dẫn giảiTrong hợp chất sulfur dioxide (SO2), nguyên tố sulfur có số oxi hoá +4, là số oxi hoá trung gian giữa các số oxi hoá -2 và +6. Do vậy, khi tham gia phản ứng oxi hoá – khử, SO2 có thể bị khử hoặc bị oxi hoá.
(Trả lời bởi Quoc Tran Anh Le)
Luyện tập 3 (SGK Cánh Diều trang 42)
Hoàn thành phương trình hoá học phản ứng đốt cháy FeS2 trong khoáng vật pyrite:
FeS2 + O2 → Fe2O3 + (A)

Thảo luận (1)Hướng dẫn giải
Câu hỏi 3 (SGK Cánh Diều trang 42)
Hãy giải thích cơ sở hóa học của một số biện pháp giảm thải lượng sulfur dioxide vào không khí.
Thảo luận (1)Hướng dẫn giảiMột số biện pháp giảm thải lượng sulfur dioxide vào không khí:
• Thay thế dần các nhiên liệu hoá thạch bằng nhiên liệu thân thiện môi trường như ethanol, hydrogen,... kết hợp với khai thác các nguồn năng lượng tái tạo như năng lượng mặt trời, năng lượng gió.
→ Cơ sở: Giảm nguồn phát thải khí SO2 bằng cách sử dụng nhiên liệu, năng lượng xanh.
• Dẫn khí thải của các nhà máy vào tháp hoặc bồn chứa các chất hấp phụ phù hợp, như than hoạt tính, hấp phụ khí sulfur dioxide, trước khi thải khí ra môi trường.
→ Cơ sở: Xử lý khí thải độc hại trước khi xả thải ra môi trường. Chuyển hoá sulfur dioxide thành các chất ít gây ô nhiễm.
SO2 + C → S↓ + CO2
• Chuyển hoá sulfur dioxide thành các chất ít gây ô nhiễm hơn bằng các hoá chất như vôi sống (thành phần chính là CaO), vôi tôi (thành phần chính là Ca(OH)2) hoặc đá vôi nghiền (thành phần chính là CaCO3).
→ Cơ sở: Xử lý khí thải độc hại trước khi xả thải ra môi trường. Chuyển hoá sulfur dioxide thành các chất ít gây ô nhiễm
SO2 + CaCO3 → CaSO4↓
(Trả lời bởi Quoc Tran Anh Le)
Vận dụng (SGK Cánh Diều trang 43)
Vì sao nói hydrogen cũng như ethanol là nhiên liệu thân thiện với môi trường (nhiên liệu xanh)?
Thảo luận (1)Hướng dẫn giải- Nhiên liệu hydrogen thân thiện với môi trường vì sản phẩm của quá trình tiêu thụ nhiên liệu ở động cơ là nước tinh khiết mà không có chất thải nào gây hại đến môi trường, không phát thải khí CO2 gây biến đổi khí hậu toàn cầu, là nguồn năng lượng gần như vô tận và có thể tái sinh được.
- Ethanol là loại nhiên liệu sạch thay thế xăng dầu được các nhà sản xuất đánh giá cao với nhiều ưu điểm: Tạo ra lượng khí thải carbon dioxide, hydrocarbon và oxide của nitrogen thấp hơn xăng dầu. Dễ bay hơi và thải ít khí ra môi trường hơn xăng dầu. Chi phí sản xuất ethanol thấp hơn xăng dầu.
(Trả lời bởi Quoc Tran Anh Le)