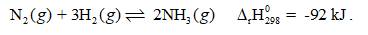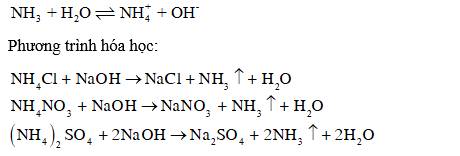Ammonia là một hợp chất của hydrogen và nitrogen, có rất nhiều ứng dụng trong đời sống và sản xuất. Ammonia có những tính chất và ứng dụng gì?
Bài 4. Ammonia và một số hợp chất ammonium
Mở đầu (SGK Chân trời sáng tạo trang 24)
Thảo luận (1)
Câu hỏi 1 (SGK Chân trời sáng tạo trang 24)
Quan sát Hình 4.1, mô tả cấu tạo phân tử ammonia. Dự đoán tính tan (trong nước) và tính oxi hóa – khử của ammonia. Giải thích.
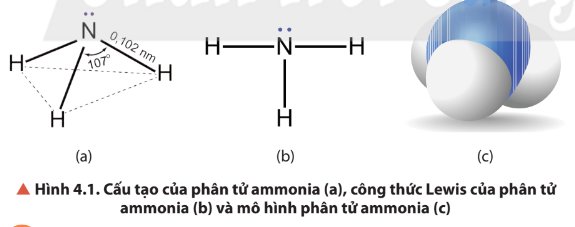
Thảo luận (1)Hướng dẫn giải- Phân tử ammonium có dạng hình chóp tam giác, được cấu tạo bởi 3 liên kết cộng hóa trị phân cực N – H. Trên nguyên tử N còn 1 cặp electron hóa trị chưa tham gia liên kết.
- Các liên kết NH3 là liên kết cộng hoá trị phân cực nên các phân tử ammonia dễ tạo liên kết hydrogen với nhau và với phân tử nước. Vì tạo được liên kết hydrogen với nước nên ammonia tan rất nhiều trong nước.
- Số oxi hóa của N trong NH3 là -3. Đây là số oxi hóa thấp nhất của N nên trong các phản ứng oxi hóa khử, ammonia đóng vai trò là chất khử.
(Trả lời bởi Mai Trung Hải Phong)
Câu hỏi 2 (SGK Chân trời sáng tạo trang 25)
Quan sát Hình 4.2, giải thích hiện tượng thí nghiệm. Từ đó cho biết tại sao không thu khí ammonia bằng phương pháp đẩy nước.

Thảo luận (1)Hướng dẫn giảitham khảo.
Khí ammonia tan nhiều trong nước. làm áp suất trong bình khí chứa ammonia giảm, hút nước có pha phenolphthalein lên bình, phun thành tia; khí ammonia có tính base, làm phenolphthalein hóa hồng nên các tia nước phun lên có màu hồng.
Vì khí ammonia tan nhiều trong nước, nên không thể sử dụng phương pháp đẩy nước để thu khí ammonia.
(Trả lời bởi Mai Trung Hải Phong)
Câu hỏi 3 (SGK Chân trời sáng tạo trang 25)
Tính tỉ khối của NH3 so với không khí. Từ kết quả đó, hãy giải thích vì sao có thể thu khí NH3 bằng phương pháp đẩy không khí (úp ngược bình).
Thảo luận (1)Hướng dẫn giải
Câu hỏi 4 (SGK Chân trời sáng tạo trang 25)
Từ sự kết hợp giữa NH3 với nước, nhận xét tính acid — base của NH3 trong dung dịch. Nêu cách nhận biết khí NH3 bằng quỳ tím. Giải thích.
Thảo luận (1)Hướng dẫn giảitham khảo.
Khi tan trong nước, ammonia nhận thêm H+ từ nước, do đó ammonia có tính base.
\(NH_3+H_2O⇌NH^+_4+OH\)
Dung dịch ammonia có tính base. Khi sử dụng quỳ tím ẩm để nhận biết khí ammonia, quỳ tím hóa xanh.
(Trả lời bởi Mai Trung Hải Phong)
Câu hỏi 5 (SGK Chân trời sáng tạo trang 25)
Chuẩn bị hai đầu đũa thuỷ tinh quấn bông. Đũa 1 nhúng vào dung dịch HCl đặc, đũa 2 nhúng vào dung dịch NH3 đặc, sau đó đưa lại gần nhau (Hình 4.3). Quan sát và nêu hiện tượng xảy ra. Từ đó để xuất phương pháp nhận biết ammonia bằng dung dịch HCl đặc.

Thảo luận (2)Hướng dẫn giảiHiện tượng: Khi đưa hai đũa nhúng HCl đặc và NH3 đặc lại gần nhau, xuất hiện khói trắng.
Phương pháp nhận biết ammonia: sử dụng HCl đặc. Hiện tượng: xuất hiện khói trắng là muối ammonium chloride (NH4Cl).
Phương trình hóa học: NH3 + HCl → NH4Cl
(Trả lời bởi Mai Trung Hải Phong)
Câu hỏi 6 (SGK Chân trời sáng tạo trang 26)
Cho biết ammonia thể hiện tính chất gì trong phản ứng với acid và oxygen.
Thảo luận (2)Hướng dẫn giải
Câu hỏi 7 (SGK Chân trời sáng tạo trang 26)
Dựa vào nguyên lí chuyển dịch cân bằng Le Chatelier, hãy cho biết để tăng hiệu suất phản ứng tổng hợp NH3 cần điều chỉnh nhiệt độ và áp suất như thế nào. Điều đó có gây trở ngại gì cho phản ứng tổng hợp NH3 trên thực tế hay không? Vì sao?
Thảo luận (1)Hướng dẫn giải
Trong phản ứng tổng hợp NH3:
+ Phản ứng thuận là phản ứng tỏa nhiệt, theo nguyên lí chuyển dịch cân bằng Le Chatelier, để phản ứng chuyển dịch theo chiều thuận, ta cần giảm nhiệt. Tuy nhiên, khi thực hiện phản ứng ở nhiệt độ quá thấp thì tốc độ của phản ứng nhỏ, phản ứng diễn ra chậm. Do đó người ta chọn nhiệt độ khoảng 380 °C – 450 °C.
+ Phản ứng thuận là phản ứng làm giảm số mol khí, theo nguyên lí chuyển dịch cân bằng Le Chatelier, để phản ứng chuyển dịch theo chiều thuận, ta cần tăng áp suất. Trên thực tế, người ta thực hiện phản ứng trên ở áp suất 25 bar – 200 bar.
(Trả lời bởi Mai Trung Hải Phong)
Câu hỏi 8 (SGK Chân trời sáng tạo trang 27)
Quan sát Hình 4.5, cho biết trạng thái, màu sắc của muối ammonium chloride và đặc tính liên kết của phân tử.

Thảo luận (2)Hướng dẫn giảiMuối ammoium chloride ở trạng thái rắn, màu trắng.
Phân tử chứa liên kết ion được tạo bởi ion ammonium (NH4+) và chloride (Cl-). Muối ammonium là tinh thể ion.
(Trả lời bởi Mai Trung Hải Phong)
Câu hỏi 9 (SGK Chân trời sáng tạo trang 27)
Quan sát Thí nghiệm, nếu hiện tượng xảy ra. Giải thích. Viết phương trình hoá học khi cho NH4Cl, NH4NO3, (NH4)2SO4 tác dụng với dung dịch NaOH.
Thảo luận (1)Hướng dẫn giảitham khảo.
Hiện tượng: Khi đun nóng dung dịch muối ammonium với NaOH đặc, xuất hiện khí có mùi khai, xốc. Đặt mẩu quỳ tím ẩm lên miệng ống nghiệm, quỳ tím hóa xanh.
Giải thích: Khi đun nóng dung dịch muối ammonium với NaOH đặc, sinh ra khí ammonia có mùi khai, xốc. Khí ammonia tiếp xúc với nước trong quỳ tím ẩm, ammonia nhận H+ của nước, tạo thành ion ammonium (), dung dịch có tính base yếu, làm giấy quỳ tím hóa xanh.
(Trả lời bởi Mai Trung Hải Phong)