Hãy nêu một số thiết bị sử dụng acquy mà em biết.
Bài 12. Thế điện cực và nguồn điện hoá học
Câu hỏi 9 (SGK Chân trời sáng tạo - Trang 68)
Thảo luận (1)
Câu hỏi 10 (SGK Chân trời sáng tạo - Trang 68)
Tìm hiểu và nêu ưu, nhược điểm của pin nhiên liệu, pin mặt trời và acquy.
Thảo luận (1)Hướng dẫn giải(Trả lời bởi Nguyễn Quốc Đạt)
Ưu điểm
Nhược điểm
Pin nhiên liệu
Tạo điện năng trực tiếp từ phản ứng hoá học nên có hiệu suất chuyển hoá từ nhiên liệu sang điện năng cao.
Pin nhiên liệu hydrogen không tạo ra các sản phẩm gây ô nhiễm môi trường.
Giá thành pin nhiên liệu cao vì cấu tạo phức tạp của pin (gồm các điện cực phủ xúc tác, lớp màng đặc biệt giữa hai điện cực, dung dịch trong pin…) cũng như phải có bộ phận lưu trữ nhiên liệu, đặc biệt là hydrogen.
Pin mặt trời
Sử dụng nguồn năng lượng vô tận là ánh sáng mặt trời, không tạo ra bất kì sản phẩm hoá học nào nên thân thiện với môi trường.
Chỉ sinh ra dòng điện khi có ánh sáng mặt trời, công suất dòng điện tỉ lệ với cường độ ánh sáng. Khi pin hết hạn việc xử lí không đúng cách sẽ gây ô nhiễm môi trường đất.
Acquy
Vòng đời sử dụng được kéo dài do có thể nạp lại để tái sử dụng mà không cần phải thay thế viên pin.
Chi phí sản xuất acquy thường lớn hơn so với pin thông thường; acquy cũ, hỏng không được thu gom và xử lí đúng cách sẽ gây ô nhiễm môi trường bởi các thành phần kim loại, hoá chất cũng như lớp vỏ của acquy (bằng nhựa khó phân huỷ).
Vận dụng mục 4 (SGK Chân trời sáng tạo - Trang 68)
Lắp ráp thêm một số pin đơn giản từ các nguyên liệu khác và đo sức điện động của pin.
Thảo luận (1)Hướng dẫn giảiVí dụ: Lắp pin chuối
Chuẩn bị:
Hoá chất: các thanh kim loại: kẽm, đồng; quả chuối…
Dụng cụ: dây điện có sẵn kẹp cá sấu hai đầu, vôn kế.
Tiến hành:
- Cắm hai thanh kim loại vào quả chuối.
- Nối cực âm của vôn kế với thanh kẽm và cực dương của vôn kế với thanh đồng.
Chú ý: Không để hai thanh kim loại tiếp xúc với nhau.
Đo sức điện động của pin.
(Trả lời bởi Nguyễn Quốc Đạt)
Bài tập 1 (SGK Chân trời sáng tạo - Trang 69)
Cho các kim loại: K, Mg, Al, Ag. Hãy viết các cặp oxi hoá - khử tạo bởi các kim loại đó và dựa vào bảng giá trị thế điện cực chuẩn, sắp xếp theo thứ tự giảm dần tính oxi hóa của các ion kim loại tương ứng.
Thảo luận (1)Hướng dẫn giải- Cặp oxi hoá – khử tạo bởi các kim loại K, Mg, Al, Ag lần lượt là: K+/K; Mg2+/Mg; Al3+/Al; Ag+/Ag.
- Dựa vào bảng thế điện cực chuẩn ta có:
Vậy, thứ tự giảm dần tính oxi hoá của các ion kim loại tương ứng: Ag+, Al3+, Mg2+, K+.
(Trả lời bởi Nguyễn Quốc Đạt)
Bài tập 2 (SGK Chân trời sáng tạo - Trang 69)
Xác định chiều của các phản ứng hoá học xảy ra giữa các cặp oxi hoá - khử: Cu2+/Cu, Zn2+/Zn và Ag+/Ag ở điều kiện chuẩn. Giải thích và viết phương trình hoá học.
Thảo luận (1)Hướng dẫn giảiChiều của phản ứng hóa học xảy ra giữa các cặp oxi hóa – khử: Kim loại của cặp oxi hoá - khử có thế điện cực chuẩn nhỏ hơn có thể khử được cation kim loại của cặp oxi hoá - khử có thế điện cực chuẩn lớn hơn ở điều kiện chuẩn.
Ta có:
Các phương trình hoá học có thể xảy ra là:
Zn + Cu2+ → Zn2+ + Cu;
Zn + 2Ag+ → Zn2+ + 2Ag;
Cu + 2Ag+ → Cu2+ + 2Ag;
(Trả lời bởi Nguyễn Quốc Đạt)
Bài tập 3 (SGK Chân trời sáng tạo - Trang 69)
Trong pin điện hoá, quá trình khử
A. xảy ra ở cực âm. B. xảy ra ở cực dương.
C. xảy ra ở cực âm và cực dương. D. không xảy ra ở cả cực âm và cực dương.
Thảo luận (1)Hướng dẫn giảiĐáp án đúng là: B
Trong pin điện hoá, quá trình khử xảy ra ở cathode (điện cực dương).
(Trả lời bởi Nguyễn Quốc Đạt)
Bài tập 4 (SGK Chân trời sáng tạo - Trang 69)
Khi pin Galvani Zn-Cu hoạt động thì nồng độ
A. Cu2+ giảm, Zn2+ tăng. B. Cu2+ giảm, Zn2+ giảm.
C. Cu2+ tăng, Zn2+ tăng. D. Cu2+ tăng, Zn2+ giảm.
Thảo luận (1)Hướng dẫn giảiĐáp án đúng là: A
Phản ứng oxi hoá – khử xảy ra trong pin:
Zn + Cu2+ → Zn2+ + Cu
Vậy, khi pin Galvani Zn-Cu hoạt động thì nồng độ Cu2+ giảm, Zn2+ tăng.
(Trả lời bởi Nguyễn Quốc Đạt)
Bài tập 5 (SGK Chân trời sáng tạo - Trang 69)
Cho một pin điện hoá được tạo bởi các cặp oxi hoá khử Fe2+/Fe, Ag+/Ag ở điều kiện chuẩn. Quá trình xảy ra ở cực âm khi pin hoạt động là
A. Fe → Fe2+ + 2e B. Fe2+ + 2e → Fe
C. Ag+ + 1e → Ag D. Ag → Ag+ + 1e
Thảo luận (1)Hướng dẫn giảiĐáp án đúng là: A
Phản ứng oxi hoá – khử diễn ra trong pin:
Fe + 2Ag+ → Fe2+ + 2Ag
Trong pin điện hoá, cực âm là anode, xảy ra quá trình nhường electron.
Vậy, quá trình xảy ra ở cực âm khi pin hoạt động là: Fe → Fe2+ + 2e.
(Trả lời bởi Nguyễn Quốc Đạt)
Bài tập 6 (SGK Chân trời sáng tạo - Trang 69)
Dựa vào Bảng 12.1, tính sức điện động chuẩn của các pin điện hoá tạo bởi các cặp oxi hoá - khử sau: Fe2+/Fe và Cu2+/Cu; Sn2+/Sn và Ag+/Ag; Pb2+/Pb và Ag+/Ag.
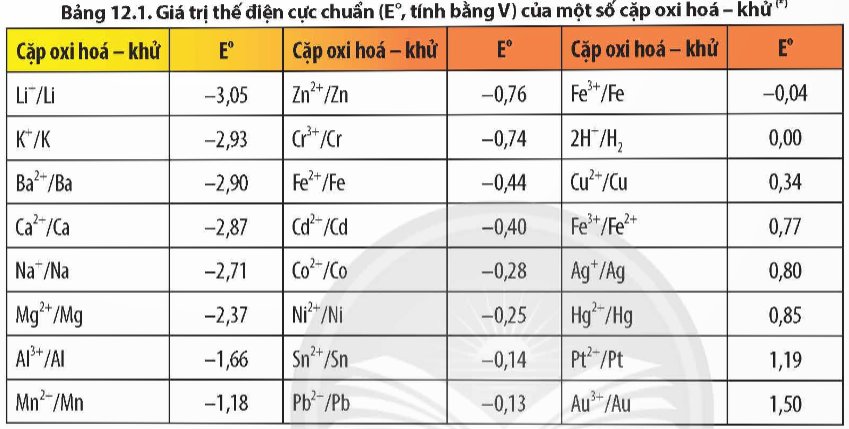
Thảo luận (1)Hướng dẫn giải- Xét pin điện hoá tạo bởi các cặp oxi hoá - khử: $\mathrm{Fe}^{2+} / \mathrm{Fe}^2$ và $\mathrm{Cu}^{2+} / \mathrm{Cu}$
Ta có: $E_{\text {Pin }}^o=E_{\text {Cathode }}^o-E_{\text {Anode }}^o=E_{C u^{2+} / C u}^o-E_{F e^{2+} / F e}^o=0,34-(-0,44)=0,78 \mathrm{~V}$.
- Xét pin điện hoá tạo bởi các cặp oxi hoá - khử: $\mathrm{Sn}^{2+} / \mathrm{Sn}$ và $\mathrm{Ag}^{+} / \mathrm{Ag}$Ta có: $E_{\text {Pin }}^o=E_{\text {Cathode }}^o-E_{\text {Anode }}^o=E_{A g^{+} / A g}^o-E_{S n^{2+} / S n}^o=0,8-(-0,14)=0,94 V$.
- Xét pin điện hoá tạo bởi các cặp oxi hoá - khử: $\mathrm{Pb}^{2+} / \mathrm{Pb}$ và $\mathrm{Ag}^{+} / \mathrm{Ag}$Ta có: $E_{\text {Pin }}^o=E_{\text {Cathode }}^o-E_{\text {Anode }}^o=E_{A g^{+} / A g}^o-E_{P b^{2+} / P b}^o=0,8-(-0,13)=0,93 \mathrm{~V}$.
(Trả lời bởi Nguyễn Quốc Đạt)