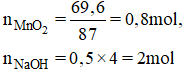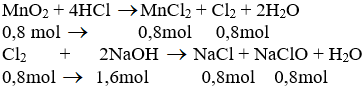a) Phương trình hóa học của phản ứng:
b) Theo pt (1): nCl2 = nMnCl2 = nMnO2 = 0,8 mol
Theo pt (2): nNaCl = nNaClO = nCl2 = 0,8 mol
nNaOH pư = 2. nCl2 = 2. 0,8 = 1,6 mol
⇒ nNaOH dư = 2 - 1,6 = 0,4 mol
Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM (NaCl) = CM (NaClO) = CM(MnCl2) = 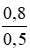
CM (NaOH)dư = 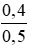
tích cho mình nha![]()