Cho đinh sắt (iron) tác dụng với dung dịch hydrochloric acid, thu được muối iron(II) chloride và khí hydrogen.
a) Viết phương trình hoá học của phản ứng ở dạng ion thu gọn.
b) Xác định các cặp oxi hoá – khử trong phản ứng trên.
Cho đinh sắt (iron) tác dụng với dung dịch hydrochloric acid, thu được muối iron(II) chloride và khí hydrogen.
a) Viết phương trình hoá học của phản ứng ở dạng ion thu gọn.
b) Xác định các cặp oxi hoá – khử trong phản ứng trên.
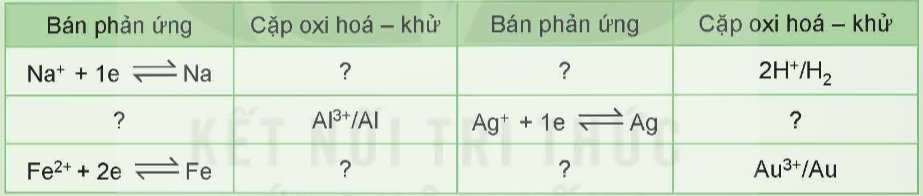
Viết bán phản ứng hoặc cặp oxi hoá – khử còn thiếu trong bảng dưới đây vào vở:
Thảo luận (1)Hướng dẫn giải
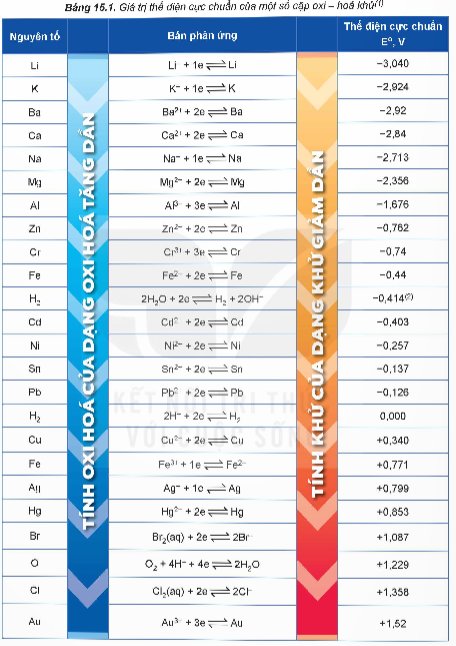
Dựa vào giá trị thế điện cực chuẩn ở Bảng 15.1, hãy viết phương trình hoá học của phản ứng xảy ra giữa các cặp oxi hoá – khử sau:
a) Ni2+/Ni và 2H+/H2;
b) Fe2+/Fe và Cu2+/Cu;
c) Zn2+/Zn và Au3+/Au.
Thảo luận (1)Hướng dẫn giảiCác phương trình hoá học:
a) Ni + 2H+ → Ni2+ + H2;
b) Fe + Cu2+ → Fe2+ + Cu;
c) 3Zn + 2Au3+ → 3Zn2+ + 2Au.
(Trả lời bởi Nguyễn Quốc Đạt)
Cho các cặp oxi hoá – khử sau: Na+/Na; Mg2+/Mg; Zn2+/Zn; Al3+/Al; Fe2+/Fe; Ag+/Ag; 2H+/H2; Cu2+/Cu.
Dựa vào Bảng 15.1, sắp xếp các cặp oxi hoá – khử trên theo chiều giảm dần tính khử của dạng khử.

Thảo luận (1)Hướng dẫn giảiSắp xếp các cặp oxi hoá – khử trên theo chiều giảm dần tính khử của dạng khử:
Na+/Na; Mg2+/Mg; Al3+/Al; Zn2+/Zn; Fe2+/Fe; 2H+/H2; Cu2+/Cu; Ag+/Ag.
(Trả lời bởi Nguyễn Quốc Đạt)
Ở điều kiện chuẩn, kim loại M có thể tác dụng được với dung dịch acid (H+), với nước khi giá trị thế điện cực chuẩn của cặp oxi hoá – khử kim loại Mn+/M thoả mãn điều kiện nào?
Thảo luận (1)Hướng dẫn giảiỞ điều kiện chuẩn, kim loại M có thể tác dụng được với dung dịch acid (H+), với nước khi giá trị thế điện cực chuẩn của cặp oxi hoá – khử kim loại Mn+/M nhỏ hơn giá trị thế điện cực chuẩn của cặp oxi hoá – khử 2H+/H2.
(Trả lời bởi Nguyễn Quốc Đạt)
Phản ứng oxi hoá – khử luôn kèm theo sự chuyển electron từ chất khử sang chất oxi hoá. Nếu các quá trình oxi hoá, quá trình khử xảy ra trên hai điện cực và electron được truyền từ chất khử sang chất oxi hoá qua dây dẫn thì năng lượng của phản ứng hoá học sẽ chuyển thành năng lượng điện.
Xét phản ứng oxi hoá – khử:

Phản ứng hoá học trên xảy ra trong hai thí nghiệm sau:
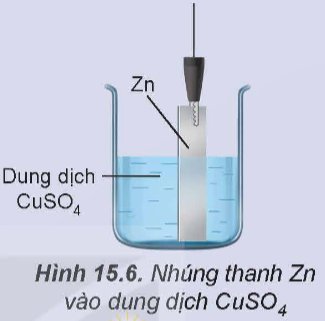
Thí nghiệm 1: Cho Zn tiếp xúc trực tiếp với ion Cu2+ bằng cách nhúng thanh Zn vào dung dịch CuSO4 (Hình 15.6), thấy xuất hiện kim loại đồng màu đỏ bám trên bề mặt thanh kẽm.
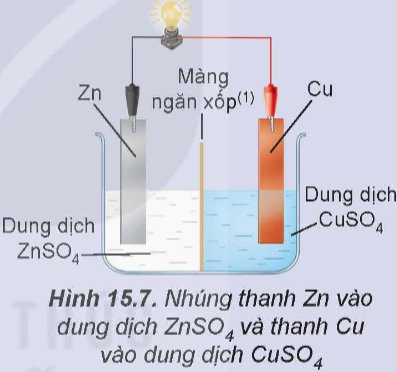
Thí nghiệm 2: Lắp hệ điện hoá gồm hai điện cực Zn2+/Zn và Cu2+/Cu như Hình 15.7, thấy bóng đèn sáng.
Thực hiện các yêu cầu sau:
1. Viết quá trình oxi hoá, quá trình khử trong mỗi thí nghiệm.
2. Trong thí nghiệm nào thì quá trình oxi hoá và quá trình khử cùng xảy ra trên bề mặt của một thanh kim loại?
3. Tại sao trong thí nghiệm 2 bóng đèn lại sáng?
Thảo luận (1)Hướng dẫn giải1. Thí nghiệm 1:
Quá trình oxi hoá: Zn → Zn2+ + 2e;
Quá trình khử: Cu2+ + 2e → Cu.
Thí nghiệm 2:
Quá trình oxi hoá: Zn → Zn2+ + 2e;
Quá trình khử: Cu2+ + 2e → Cu.
2. Trong thí nghiệm 1, quá trình oxi hoá và quá trình khử cùng xảy ra trên bề mặt của một thanh kim loại.
3. Trong thí nghiệm 2, bóng đèn lại sáng vì các quá trình oxi hoá, quá trình khử xảy ra trên hai điện cực và electron được truyền từ chất khử sang chất oxi hoá qua dây dẫn thì năng lượng của phản ứng hoá học sẽ chuyển thành năng lượng điện.
(Trả lời bởi Nguyễn Quốc Đạt)
Chuẩn bị:
Hoá chất: các thanh kim loại: kẽm, đồng, nhôm, sắt; quả chanh (hoặc quả cam, quả chuối, củ khoai tây,...).
Dụng cụ: dây điện có sẵn kẹp cá sấu hai đầu, vôn kế.
Tiến hành:
- Chọn hai điện cực là hai kim loại khác nhau, ví dụ như thanh kẽm và thanh đồng.
- Cắm hai thanh kim loại vào quả chanh. (Hình 15.11 a)
- Nối cực âm của vôn kế với thanh kẽm và cực dương của vôn kế với thanh đồng.

Thực hiện yêu cầu sau:
Đo sức điện động của pin đã lắp ráp theo Hình 15.11 a.
(Lưu ý: Có thể mắc nối tiếp các pin như minh hoạ ở Hình 15.11 b).
Thảo luận (1)Hướng dẫn giảiHọc sinh tiến hành thí nghiệm và đo sức điện động của pin.
Tham khảo các bước sau: (Nguồn Internet)
(Trả lời bởi Nguyễn Quốc Đạt)
Phân loại các loại pin sử dụng trong gia đình và đề xuất cách thu gom, xử lí khi hết hạn sử dụng để bảo vệ môi trường.
Thảo luận (1)Hướng dẫn giảiPhân loại các loại pin sử dụng trong gia đình:
- Acquy: là nguồn điện được sử dụng phổ biến trong các phương tiện giao thông, thiết bị lưu điện, phát điện…
- Pin nhiên liệu: là loại pin điện hoá chuyển đổi hoá năng thành năng lượng điện năng thông qua phản ứng oxi hoá – khử.
- Pin Mặt Trời gồm nhiều tấm vật liệu bán dẫn được ghép nối với nhau, có khả năng chuyển đổi quang năng thành điện năng.
- Pin lithium – ion: thuộc loại pin sạc, sử dụng trong laptop, điện thoại, máy quay phim, phương tiện giao thông chạy điện …
- Pin khô: thuộc loại pin sơ cấp, không sạc, được dùng trong thiết bị điều khiển, máy ảnh, đồ chơi …
Cách thu gom, xử lí pin khi hết hạn sử dụng để bảo vệ môi trường:
- Không nên vứt pin đã hết hạn vào thùng rác sinh hoạt vì trong cấu tạo mỗi viên pin đều chứa các kim loại nặng, độc hại.
- Cho các pin hết hạn vào lọ thuỷ tinh sạch, để nơi khô ráo, tránh nhiệt độ quá cao, tránh xa tầm tay trẻ em … rồi đưa đến các điểm thu gom pin đã qua sử dụng. Các điểm này thường có ở siêu thị, cửa hàng tiện ích hoặc sảnh chung cư …
(Trả lời bởi Nguyễn Quốc Đạt)
Một pin Galvani được thiết lập ở điều kiện chuẩn theo sơ đồ Hình 15.10.
Dựa vào giá trị thế điện cực chuẩn ở Bảng 15.1:
a) Xác định anode, cathode và viết các quá trình xảy ra ở anode, cathode. Viết phương trình hoá học của phản ứng xảy ra trong pin.
b) Tính sức điện động chuẩn của pin và so sánh với giá trị hiển thị trên vôn kế.
c) Xác định chiều của dòng electron chạy qua dây dẫn.
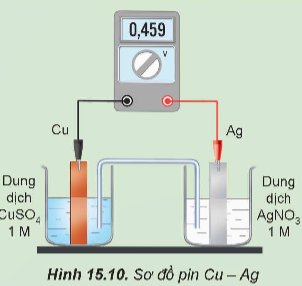

Thảo luận (1)Hướng dẫn giảia) Thanh Cu là nguồn cung cấp electron nên đóng vai trò là anode (cực âm). Ở thanh Cu xảy ra quá trình: Cu → Cu2+ + 2e.
Thanh Ag là nơi nhận electron nên đóng vai trò là cathode (cực dương). Ở thanh Ag xảy ra quá trình: Ag+ + 1e → Ag.
Phương trình hoá học của phản ứng xảy ra trong pin:
Cu + 2Ag+ → Cu2+ + 2Ag
b) Sức điện động chuẩn của pin:
Giá trị này bằng với giá trị hiển thị trên vôn kế.
c) Chiều của dòng electron chạy qua dây dẫn: Electron được truyền từ chất khử sang chất oxi hoá qua dây dẫn hay chiều từ anode sang cathode.
(Trả lời bởi Nguyễn Quốc Đạt)
Nghiên cứu về chiều phản ứng giữa các cặp oxi hoá – khử
Xét hai phản ứng oxi hoá – khử sau:
Zn + Cu2+ → Zn2+ + Cu (1)
Cu + 2Ag+ → Cu2+ + 2Ag (2)
1. Dựa vào Bảng 15.1, so sánh thế điện cực chuẩn của các cặp oxi hoá – khử: Zn2+/Zn với Cu2+/ Cu; Cu2+/ Cu với Ag+/Ag.
2. Chỉ ra chất khử mạnh hơn và chất oxi hoá mạnh hơn trong mỗi phản ứng.
3. Dựa vào giá trị thế điện cực chuẩn, rút ra nhận xét chung về chiều phản ứng giữa các cặp oxi hoá – khử ở trên.

Thảo luận (1)Hướng dẫn giải1. Ta có:
2. Xét phản ứng (1): Zn có tính khử mạnh hơn Cu; Cu2+ có tính oxi hoá mạnh hơn Zn2+.
Xét phản ứng (2): Cu có tính khử mạnh hơn Ag; Ag+ có tính oxi hoá mạnh hơn Cu2+.
3. Nhận xét: Chất khử của cặp oxi hoá – khử có thế điện cực nhỏ hơn tác dụng với chất oxi hoá của cặp oxi – hoá khử có thế điện cực lớn hơn, tạo ra dạng oxi hoá và dạng khử tương ứng.
(Trả lời bởi Nguyễn Quốc Đạt)