Bài 30: Ôn tập chương 8
Nội dung lý thuyết
I. Hệ thống hóa kiến thức
1. Đại cương về kim loại chuyển tiếp dãy thứ nhất
- Kim loại chuyển tiếp dãy thứ nhất gồm 9 nguyên tố thuộc chu kì 4, từ Sc (Z = 21) đến Cu (Z = 29).
- Cấu hình electron của nguyên tử các kim loại chuyển tiếp có dạng 3d1-104s1-2.
- Kim loại chuyển tiếp dãy thứ nhất có nhiệt độ nóng chảy cao, thường có độ cứng lớn, khá nặng, dẫn điện và dẫn nhiệt tốt, có nhiều ứng dụng trong thực tiễn.
- Các nguyên tố chuyển tiếp có xu hướng thể hiện nhiều trạng thái oxi hóa. Các ion kim loại chuyển tiếp thường có màu sắc phong phú.
- Sự có mặt của ion Cu2+ hoặc ion Fe3+ trong dung dịch được nhận biết bằng phản ứng tạo thành kết tủa màu xanh nhạt của Cu(OH)2 hoặc nâu đỏ của Fe(OH)3.

2. Sơ lược về phức chất
- Phức chất là hợp chất có chứa nguyên tử trung tâm và các phối tử.
- Phức chất có dạng hình học phổ biến là tứ diện, vuông phẳng và bát diện.
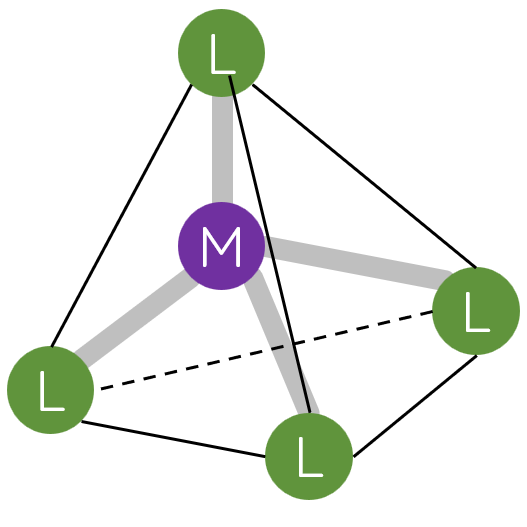
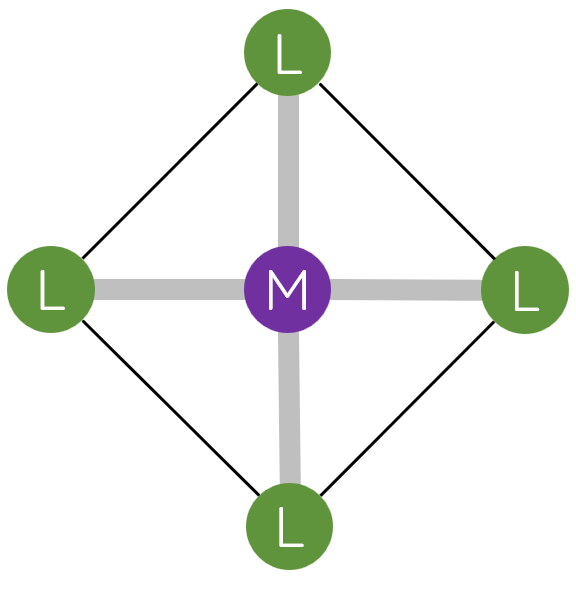
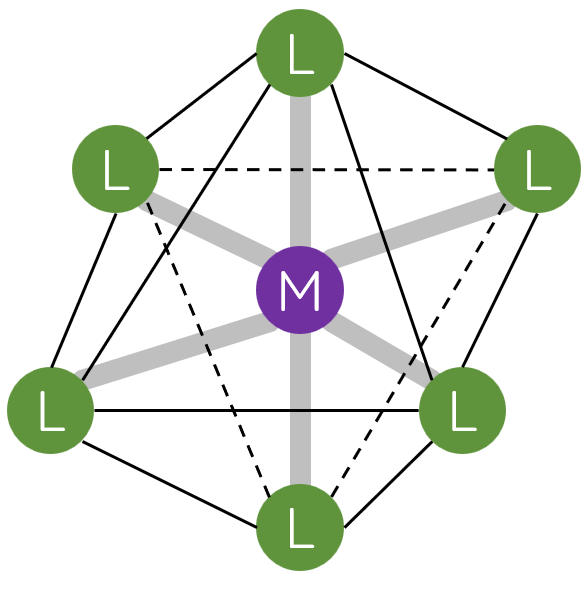
- Trong phức chất, phối tử cho cặp electron chưa liên kết vào orbital trống của nguyên tử trung tâm tạo liên kết cho – nhận.
- Sự tạo thành phức chất trong dung dịch có thể được nhận ra nhờ dấu hiệu xuất hiện kết tủa, hòa tan kết tủa, thay đổi màu sắc.
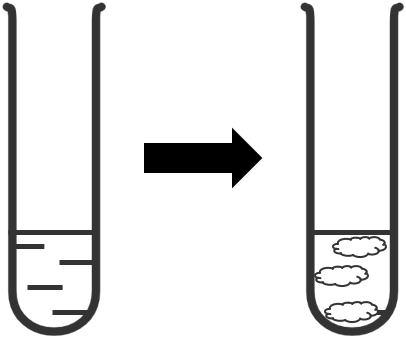
- Trong dung dịch, các ion kim loại chuyển tiếp đều tạo phức chất aqua, hầu hết có dạng hình học bát diện.

- Các phối tử trong phức chất có thể bị thay thế một phần hoặc thay thế hoàn toàn bởi các phối tử khác.
- Phức chất có ứng dụng trong y học, công nghiệp hóa chất.