Bài 27: Đại cương về kim loại chuyển tiếp dãy thứ nhất
Nội dung lý thuyết
I. Đơn chất kim loại chuyển tiếp thứ nhất
1. Đặc điểm cấu tạo nguyên tử
- Các nguyên tố từ Sc (Z = 21) đến Cu (Z = 29) được gọi là nguyên tố chuyển tiếp dãy thứ nhất.
- Đặc điểm cấu hình electron nguyên tử:
+ Lớp vỏ bên trong của khí hiếm Ar.
+ Số electron trên phân lớp 3d tăng dần từ 1 đến 10.
+ Trên phân lớp 4s, số electron bằng 2 (trừ Cr và Cu bằng 1).
- Nguyên tử của các kim loại này có nhiều electron hóa trị nên chúng thường tạo thành các hợp chất với nhiều số oxi hóa khác nhau.
2. Tính chất vật lí và ứng dụng của kim loại chuyển tiếp
| Tính chất | Đặc điểm | Ứng dụng |
| Nhiệt độ nóng chảy | Khó nóng chảy, đặc biệt là vanadium, chromium và cobalt. | Chế tạo dụng cụ, máy móc, thiết bị làm việc ở nhiệt độ cao. |
| Độ cứng | Khá cao, chromium là kim loại cứng nhất trong tất cả kim loại. | Chế tạo hợp kim không gỉ hoặc siêu cứng để sản xuất dụng cụ y tế, nhà bếp, vòng bi, mũi khoan,... |
| Khối lượng riêng | Scandium và titanium tương đối nhẹ. Các kim loại khác đều là kim loại nặng. | Chế tạo vật liệu hàng không, gọng kính; sản xuất phương tiện giao thông, máy móc, bệ máy,... |
| Độ dẫn điện | Tương đối tốt, đồng là kim loại dẫn điện tốt (chỉ sau bạc). | Chế tạo dây dẫn, thiết bị điện,... |
| Độ dẫn nhiệt | Tương đối tốt, điển hình là đồng. | Chế tạo thiết bị nồi hơi, thiết bị trao đổi nhiệt, đồ gia dụng,... |
II. Hợp chất của kim loại chuyển tiếp dãy thứ nhất
1. Số oxi hóa của nguyên tử kim loại chuyển tiếp dãy thứ nhất trong hợp chất
- Các nguyên tố chuyển tiếp dãy thứ nhất có khả năng tạo ra các hợp chất với nhiều trạng thái oxi hóa khác nhau.
Ví dụ:
| Nguyên tử | Cr | Mn | Fe | Cu |
| Số oxi hóa | +3 +6 | +2 +4 +7 | +2 +3 | +2 |
- Khi tham gia phản ứng hóa học, nguyên tử kim loại chuyển tiếp dãy thứ nhất ưu tiên nhường electron ở phân lớp 4s trước rồi đến electron ở phân lớp 3d, tạo thành các cation tương ứng.
Ví dụ:
| Fe | → | Fe2+ | + 2e |
| [Ar]3d64s2 | [Ar]3d6 |
| Fe | → | Fe3+ | + 3e |
| [Ar]3d64s2 | [Ar]3d5 |
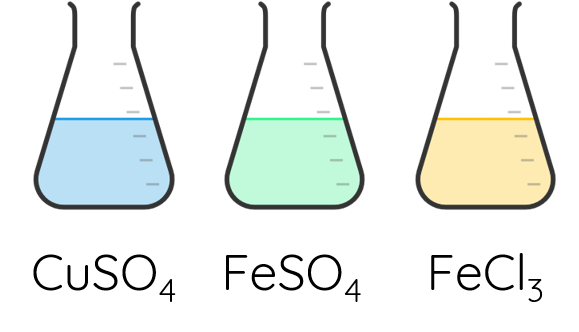
2. Màu sắc của các ion kim loại chuyển tiếp dãy thứ nhất
Các ion kim loại chuyển tiếp dãy thứ nhất có màu sắc phong phú. Chẳng hạn, trong dung dịch, ion Fe2+ có màu xanh nhạt, ion Fe3+ có màu vàng nâu, ion Cu2+ có màu xanh.
3. Chuẩn độ iron(II) sulfate bằng thuốc tím
Trong phòng thí nghiệm, nồng độ iron(II) sulfate có thể được xác định bằng phương pháp chuẩn độ với dung dịch thuốc tím trong môi trường sulfuric acid theo phương trình hóa học:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Thí nghiệm: Xác định hàm lượng muối Fe(II) bằng dung dịch thuốc tím
- Chuẩn bị:
+ Hóa chất: Các dung dịch KMnO4 0,02 M, H2SO4 10%, FeSO4 có nồng độ khoảng 0,10 M.
+ Dụng cụ: Pipette 5 mL, buratte 25 mL, bình tam giác 100 mL, ống đong 10 mL, bình tia nước cất, giá đỡ, kẹp càng cua.
- Tiến hành:
+ Dùng pipette lấy 5,0 mL dung dịch FeSO4 cho vào bình tam giác; thêm tiếp khoảng 5mL dung dịch H2SO4 10% (lấy bằng ống đong).

+ Cho dung dịch KMnO4 vào burette, điều chỉnh thể tích dung dịch trong burette về mức 0.
+ Mở khóa burette, nhỏ từng giọt dung dịch KMnO4 xuống bình tam giác, lắc đều.
Ban đầu, dung dịch trong bình tam giác xuất hiện màu hồng rồi mất màu. Tiếp tục chuẩn độ đến khi màu hồng tồn tại bền trong khoảng 20 giây thì dừng chuẩn độ.
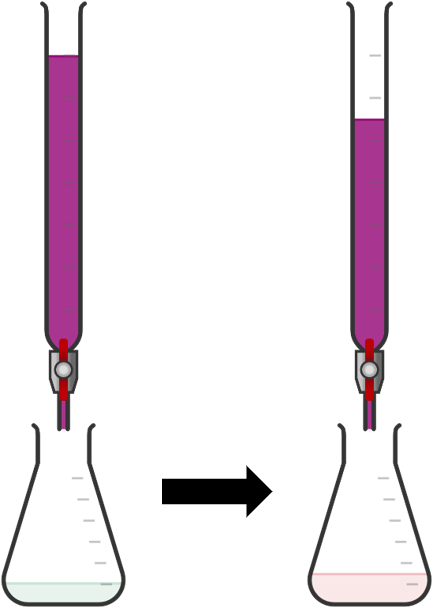
+ Ghi lại thể tích dung dịch KMnO4 đã dùng.
Tiến hành chuẩn độ 3 lần, lấy giá trị trung bình và tính toán.
4. Nhận biết một số ion kim loại chuyển tiếp
Trong hóa học, các ion kim loại chuyển tiếp thường được nhận biết dựa vào màu sắc đặc trưng của ion, hợp chất ít tan hoặc của phức chất tương ứng.