Bài 25: Flo - Brom - Iot
Nội dung lý thuyết
Các phiên bản khácI. FLO
1. Tính chất vật lý, trạng thái tự nhiên
- Ở điều kiện thường, flo là chất khí, màu lục nhạt, rất độc.
.gif)
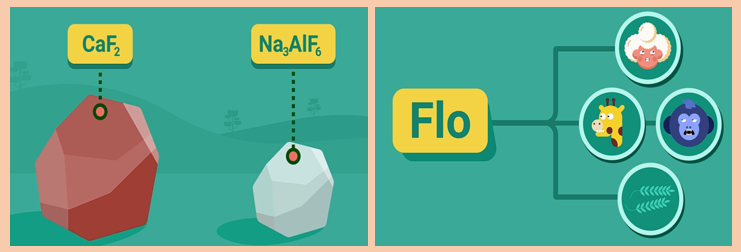
- Trong tự nhiên, flo chỉ tồn tại ở dạng hợp chất, chủ yếu trong các khoáng dạng muối như CaF2 hoặc Na3AlF6 (criolit).
- Flo cũng có trong hợp chất tạo lên men răng của người và động vật, trong lá của một số loài cây.
@94080@
2. Tính chất hóa học
Flo là nguyên tố có độ âm điện lớn nhất, do đó là phi kim có tính oxi hóa mạnh nhất.

Tính oxi hóa mãnh liệt của flo được thể hiện ở các phản ứng sau:
- Khí flo oxi được tất cả các kim loại tạo ra muối florua.
- Khí flo oxi hóa được hầu hết các phi kim trừ O2 và N2. Phản ứng được với hidro ngay cả trong bóng tối và nhiệt độ rất thấp, gây nổ mạnh, tạo thành hidro florua.
Hidro florua (HF) tan nhiều trong nước tạo thành dung dịch axit flohiđric. Axit flohiđric là axit yếu nhưng có thể ăn mòn các đồ vật bằng thủy tinh. Dựa vào tính chất này, axit HF được dùng để khắc chữ lên thủy tinh.
- Khí flo còn oxi hóa nước dễ dàng ở nhiệt độ thường, hơi nước nóng bốc cháy khi tiếp xúc với khí flo.
@94087@@94127@
3. Ứng dụng
Điều chế các hidrocacbon chứa flo để sản xuất chất chất dẻo như floroten để bảo vệ chi tiết, vật thể bằng kim loại, gốm, sứ, thủy tinh... không bị ăn mòn. | Teflon dùng để chế tạo các vòng đệm làm kín chân không, phủ lên xoong, chảo để chống dính. | CFC là chất sinh hàn có trong các thiết bị làm lạnh như điều hòa, tủ lạnh nhưng đã bị cấm sử dụng do có khí thải làm thủng tầng ozon. | Dung dịch NaF loãng dùng làm thuốc chống sâu răng. |
|
|
|
|
4. Sản xuất flo trong công nghiệp
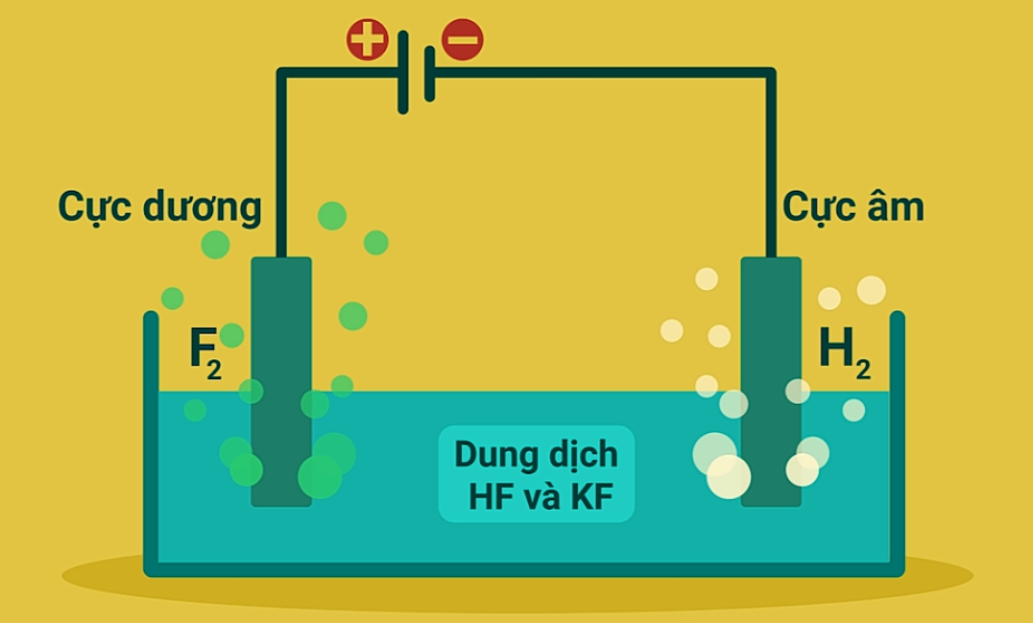
- Flo là chất có tính oxi hóa mạnh nhất nên không có chất nào có thể oxi hóa F- thành F2.
- Phương pháp duy nhất để sản xuất flo trong công nghiệp là điện phân hỗn hợp KF và HF với cực dương bằng than chì và cực âm bằng thép đặc biệt hoặc đồng. Khi đó, khí H2 thoát ra ở cực âm còn khí F2 thoát ra ở cực dương.
II. BROM
1. Tính chất vật lý, trạng thái tự nhiên
- Ở điều kiện thường, brom là chất lỏng, màu nâu đỏ, dễ bay hơi, hơi brom độc.
.gif)
- Gây bỏng nặng khi dây vào da.
- Brom tan trong nước nhưng tan tốt hơn trong các dung môi hữu cơ như etanol, benzen, xăng... Dung dịch của brom trong nước gọi là nước brom.
- Trong tự nhiên chủ yếu tồn tại ở dạng hợp chất những số lượng ít hơn nhiều so với hợp chất Clo và Flo, trong nước biển có một lượng nhỏ muối natri bromua.
@94128@
2. Tính chất hóa học
- Brom có tính oxi hóa yếu hơn clo và flo, nhưng vẫn là chất oxi hóa mạnh.

- Oxi hóa được nhiều kim loại.
- Brom chỉ oxi hóa được hidro ở nhiệt độ cao, tạo khí hidro bromua.
Hidro bromua tan trong nước tạo thành dung dịch axit bromhiđric, là axit mạnh, mạnh hơn axit clohidric HCl.
- Brom tác dụng rất chậm với nước tạo thành hỗn hợp sản phẩm là axit bromhiđric HBr và axit hipobromơ HBrO. Phản ứng xảy ra thuận nghịch.
Tương tự clo, brom vừa thể hiện tính khử, vừa thể hiện tính oxi hóa khi tác dụng với nước.
@94129@
3. Ứng dụng
| Sản xuất một số dẫn xuất hidrocacbon như C2H5Br, C2H4Br2 trong công nghiệp dược phẩm. | Một lượng lớn brom dùng để sản xuất AgBr, một chất nhạy cảm với ánh sáng dùng để tráng lên phim. Dưới tác dụng của ánh sáng phân hủy thành bạc và hơi brom. | Hợp chất brom cũng dùng nhiều trong công nghiệp dầu mỏ, hóa chất cho nông nghiệp, phẩm nhuộm và hóa chất trung gian. |
 |  |  |
4. Sản xuất brom trong công nghiệp
Trong công nghiệp, brom được sản xuất từ nước biển. Nước biển có chứa NaCl và NaBr, sau khi đã tách NaCl ra khỏi nước biển, dùng khí clo để oxi hóa NaBr để sản xuất Br2.
III. IOT
1. Tính chất vật lý và trạng thái tự nhiên
- Ở điều kiện thường, iot là chất rắn, dạng tinh thể màu đen tím.
- Khi đun nóng, iot rắn không nóng chảy thành dạng lỏng mà chuyển luôn sang dạng hơi. Hiện tượng này gọi là sự thăng hoa của iot.
- Iot ít tan trong nước và tan nhiều trong các dung môi hữu cơ như etanol, benzen, xăng... giống brom. Vì thế người ta thường dùng xăng hoặc benzen để chiết iot, brom ra khỏi nước.
- Trong tự nhiên, iot chủ yếu tồn tại dưới dạng hợp chất là muối iotua, muối này hiếm hơn muối bromua, chỉ chiếm một lượng nhỏ trong nước biển.

@94130@@94131@
2. Tính chất hóa học
Iot có bán kính nguyên tử lớn hơn so với flo, clo, brom và độ âm điện nhỏ hơn, vì vậy iot có tính oxi hóa yếu hơn flo, clo, brom.

Các phản ứng của iot hầu hết chỉ xảy ra được khi đun nóng hoặc có mặt chất xúc tác.
- Iot oxi hóa được nhiều kim loại khi đun nóng hoặc có mặt chất xúc tác.
- Iot chỉ oxi hóa được hidro ở nhiệt độ cao và có mặt chất xúc tác tạo thành hidro iotua, phản ứng diễn ra thuận nghịch.
- Khí hidro iotua tan nhiều trong nước tạo thành dung dịch axit axit iothiđric, là axit mạnh hơn và dễ bị oxi hóa hơn axit bromhiđric và axit clohiđric.
.gif)
- Iot hầu như không tác dụng với nước.
- Vì có tính oxi hóa yếu hơn clo và brom nên clo và brom có thể oxi hóa muối iotua thành iot.
.gif)
- Iot phản ứng với hồ tinh bột tạo thành hợp chất có màu xanh. Vì vậy, người ta thường dùng iot để nhận biết hồ tinh bột và ngược lại.
@94132@
3. Ứng dụng
| Phần lớn iot được dùng làm dược phẩm. Dung dịch 5% iot trong etanol (cồn iot) dùng làm thuốc sát trùng vết thương. | Chất tẩy rửa khi trộn thêm iot sẽ tẩy sạch các vết bẩn bám trên trên các thiết bị trong nhà máy chế biến bơ, sữa. | Muối iot dùng để phòng bệnh bướu cổ do thiếu iot. |
|
|
|
4. Sản xuất iot trong công nghiệp
Trong công nghiệp, người ta sản xuất iot từ dong biển.

.gif)
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt
Danh sách các phiên bản khác của bài học này. Xem hướng dẫn