Bài 23: Ôn tập chương 6
Nội dung lý thuyết
1. Cấu tạo và liên kết trong tinh thể kim loại
- Nguyên tử kim loại thường có từ 1 – 3 electron lớp ngoài cùng.
- Trong tinh thể kim loại, các ion dương chiếm những nút của mạng tinh thể, các electron hóa trị chuyển động tự do trong toàn bộ mạng tinh thể.
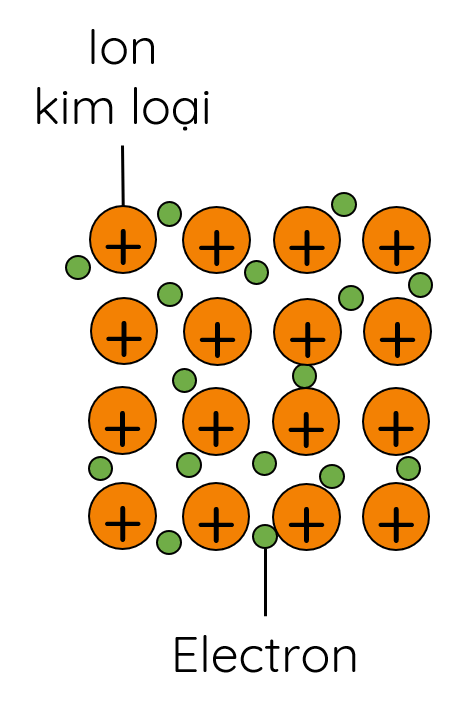
- Trong tinh thể kim loại, liên kết kim loại được hình thành do lực hút tĩnh điện giữa các electron tự do với các ion dương kim loại ở các nút mạng.
2. Tính chất vật lí và tính chất hóa học của kim loại
- Kim loại là chất rắn (trừ Hg), có tính dẻo (dễ rèn, dễ dát mỏng và dễ kéo sợi), tính dẫn điện, dẫn nhiệt và có ánh kim.
- Kim loại có tính khử: tác dụng với phi kim, nước, dung dịch acid, dung dịch muối.
3. Kim loại trong tự nhiên và phương pháp tách kim loại
- Trong tự nhiên, hầu hết kim loại tồn tại ở dạng hợp chất, chỉ một vài kim loại kém hoạt động như vàng, bạc, platimun,... được tìm thấy dưới dạng đơn chất.
- Nguyên tắc điều chế kim loại: khử ion kim loại thành nguyên tử: Mn+ + ne → M.
+ Kim loại hoạt động hóa học mạnh: điện phân nóng chảy hợp chất của chúng.
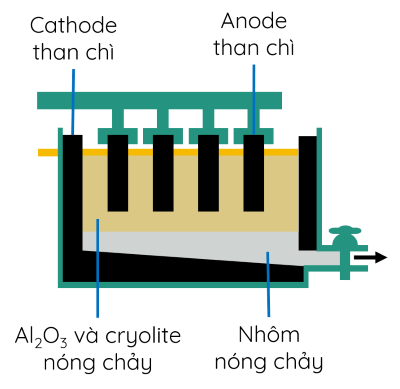
+ Kim loại hoạt động trung bình, yếu: nhiệt luyện, thủy luyện, điện phân dung dịch muối.
4. Hợp kim
- Vật liệu kim loại chứa một kim loại cơ bản và một số kim loại khác hoặc phi kim.

- Tính chất hóa học của hợp kim tương tự tính chất hóa học của kim loại thành phần.
- Tính chất vật lí thường khác nhiều so với tính chất của các kim loại thành phần như độ cứng của hợp kim thường lớn hơn độ cứng của kim loại thành phần và độ dẻo thì kém hơn. Nhiệt độ nóng chảy của hợp kim tùy thuộc vào thành phần và cấu tạo tinh thể của hợp kim.
5. Sự ăn mòn kim loại
- Ăn mòn kim loại là sự phá hủy kim loại hoặc hợp kim dưới tác dụng của các chất trong môi trường.

- Hai dạng ăn mòn kim loại là ăn mòn hóa học và ăn mòn điện hóa.
- Hai phương pháp bảo vệ kim loại là phương pháp điện hóa và phương pháp phủ bề mặt.