Bài 2. Sự điện li trong dung dịch nước. Thuyết Bronsted - Lowry về acid - base
Nội dung lý thuyết
I. Sự điện li, chất điện li và chất không điện li
Thí nghiệm: Tính dẫn điện của dung dịch muối ăn và dung dịch đường

Kết quả:
Cốc đựng nước muối: bóng đèn sáng
Cốc đựng nước đường thì bóng đèn không sáng.
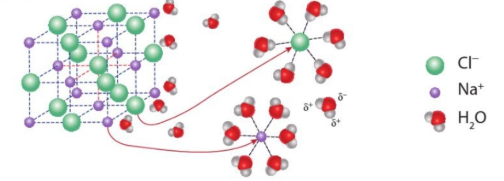
\(\Rightarrow\) Nước muối dẫn điện chứng tỏ trong dung dịch có chứa các hạt mang điện chuyển động tự do, đó chính là các ion. Vậy muối ăn khi tan trong nước sẽ phân li thành các ion. Ngược lại, đường tan trong nước không tạo ra các ion nên dung dịch không dẫn điện.
Quá trình phân li các chất khi tan trong nước thành các ion được gọi là sự điện li.
Chất điện li là chất khi tan trong nước phân li thành các ion.
Chất không điện li là chất khi tan trong nước không phân li thành các ion.
Chất điện li là chất khi tan trong nước phân li thành các ion.
Chất không điện li là chất khi tan trong nước không phân li thành các ion.
- Hầu hết các acid, base và muối tan được trong nước thuộc loại chất điện li.
- Rất nhiều chất hữu cơ tan được trong nước như đường saccharose, ethanol, glycerol,... là những chất không điện li.
- Nước đóng vai trò quan trọng trong sự điện li của một chất. Do nước là phân tử phân cực nên khi hoà tan một chất điện li vào nước, xuất hiện tương tác của nước với các ion. Tương tác này sẽ bứt các ion khỏi tinh thể (hoặc phân tử) để tan vào nước.
II. Thuyết Bronsted - Lowry về acid - base
1. Thuyết Bronsted - Lowry về acid - base
Theo thuyết Arrhenius: Acid là những chất khi tan trong nước phân li ra \(H^+\) (proton), base là những chất khi tan trong nước phân li ra \(OH^-\).
Thuyết Brønsted - Lowry về acid - base: Acid là những chất có khả năng cho \(H^+\), base là những chất có khả năng nhận \(H^+\).
- Trong thực tế, \(H^+\) không tồn tại độc lập trong nước mà dễ dàng kết hợp với \(H_2O\) để tạo thành ion \(H_3O^+\) (hydronium) nên sự phân li của \(HCl\) trong nước được viết lại dưới dạng:
\(HCl+H_2O\rightarrow H_3O^++Cl^-\)
- Để đơn giản, trong dung môi nước, sự phân li của \(HCl\) được viết dưới dạng:
\(HCl\rightarrow H^++Cl^-\)
Ví dụ 2: Ammonia (\(NH_3\)) khi tan trong nước có phản ứng với nước:
\(NH_3+H_2O⇌NH_4^++OH^-\)
base acid
Cặp \(NH_4^+/NH_3\) là cặp acid/base liên hợp.
Ví dụ 3: Trong dung dịch nước của acetic acid tồn tại cân bằng sau:
\(CH_3COOH+H_2O⇌H_3O^++CH_3COO^-\)
acid base
Cặp \(CH_3COOH/CH_3COO^-\) là cặp acid/base liên hợp.
2. Acid mạnh / base mạnh và acid yếu / base yếu
Acid mạnh và base mạnh phân li hoàn toàn trong nước (nên không tồn tại dạng phân tử trong nước). Acid yếu và base yếu phân li một phần trong nước.
\(HCl\rightarrow H^++Cl^-\\ CH_3COOH⇌CH_3COO^-+H^+\)
- Theo thuyết Brønsted – Lowry, nhiều ion như \(Fe^{3+}\), \(Al^{3+}\), \(CO_3^{2-}\)... sẽ đóng vai trò là acid hoặc base trong nước.
\(Al^{3+}+3H_2O⇌Al\left(OH\right)_3+3H^+\\ CO_3^{2-}+H_2O⇌HCO_3^-+OH^-\\ HCO_3^-+H_2O⇌H_2CO_3+OH^-\)
- Các phản ứng trên còn được gọi là phản ứng thuỷ phân. Phản ứng thuỷ phân của những ion này có nhiều ý nghĩa trong thực tiễn.
- Phèn nhôm (hay phèn chua) có công thức \(KAl\left(SO_4\right)_2.12H_2O\), trong nước bị phân li hoàn toàn:
\(KAl\left(SO_4\right)_2.12H_2O\rightarrow K^++Al^{3+}+2SO_4^{2-}+12H_2O\)
Chất này thường được dùng để làm trong nước và làm chất cầm màu trong công nghiệp nhuộm, in bởi ion \(Al^{3+}\) tạo ra \(Al\left(OH\right)_3\) ở dạng kết tủa keo,... có khả năng hấp phụ các chất rồi lắng xuống đáy bể hoặc gắn vào sợi vải cần nhuộm.
- Sodium carbonate (\(Na_2CO_3\)) có rất nhiều ứng dụng. Trong công nghiệp sản xuất chất tẩy rửa, dung dịch này được sử dụng để làm sạch các vết dầu mỡ bám trên bề mặt kim loại trước khi sơn, mạ, do ion \(OH^-\) (sinh ra từ phản ứng thuỷ phân) phản ứng được với các chất dầu, mỡ (thuộc loại ester hữu cơ).