Bài 2: Nguyên tố hóa học
Nội dung lý thuyết
Các phiên bản khácI. Nguyên tố hóa học
Là tập hợp các nguyên tử có cùng số đơn vị điện tích hạt nhân.
Trong nguyên tử, số đơn vị điện tích hạt nhân bằng số electron ở vỏ nguyên tử.
Các nguyên tử của cùng một nguyên tố hóa học có tính chất hóa học giống nhau.
Ví dụ: Tất cả nguyên tử có cùng số đơn vị điện tích hạt nhân là 6 đều thuộc nguyên tố carbon dùng chúng có thể có số neutron khác nhau.

Hiện nay, con người đã biết 118 nguyên tố hóa học, trong đó có 94 nguyên tố hóa học tồn tại trong tự nhiên và 24 nguyên tố được tạo ra trong phòng thí nghiệm, thậm chí có những nguyên tố mới chỉ tạo ra được một lượng rất ít, thời gian tồn tại rất ngắn.
@2014029@
II. Kí hiệu nguyên tử
Số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố hóa học (còn được gọi là số hiệu nguyên tử (Z) của nguyên tố đó và số khối (A) là những đặc trưng cơ bản của một nguyên tử.
Ví dụ: Kí hiệu \(^4_2He\) cho biết:
- Nguyên tử helium có kí hiệu là He.
- Số hiệu nguyên tử helium bằng 2 nên trong hạt nhân helium có 2 proton, vỏ nguyên tử có 2 electron
- Số khối của nguyên tử He là 4 nên trong hạt nhân có số neutron là 4 - 2 = 2
@2014082@
III. Đồng vị
Một số nguyên tử có cùng số proton nhưng có số neutron khác nhau, những nguyên tử như vậy được gọi là đồng vị.
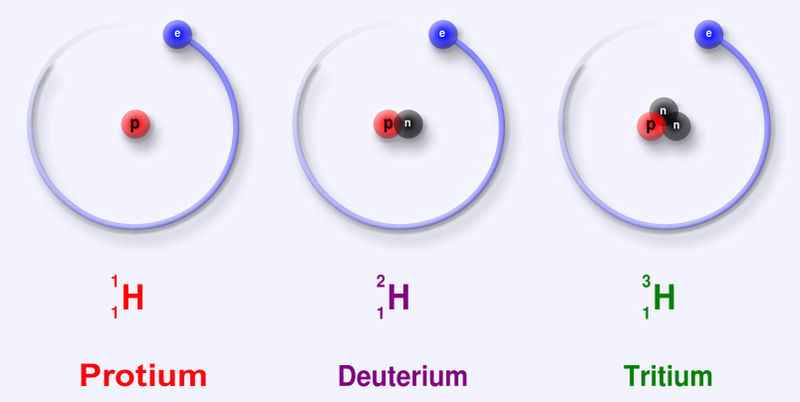
Mô hình cấu tạo nguyên tử các đồng vị của nguyên tố hydrogen
Các đồng vị khác nhau về số neutron nên cũng khác nhau về khối lượng của hạt nhân nguyên tử, đồng thời cũng khác nhau về một số tính chất vật lí.
Ví dụ: ở dạng đơn chất, đồng vị \(^{37}_{17}Cl\) có tỉ khối lớn hơn, nhiệt độ nóng chảy và nhiệt độ sôi cao hơn đồng vị \(^{35}_{17}Cl\).
Ngoài các đồng vị bền, các nguyên tố hóa học còn có đồng vị không bền được gọi là đồng vị phóng xạ. Nhiều đồng vị phóng xạ được sử dụng trong y học, nông nghiệp, công nghiệp, nghiên cứu khoa học,...
@2014228@@2014317@
IV. Nguyên tử khối
1. Nguyên tử khối
Nguyên tử khối là khối lượng tương đối của nguyên tử.
Do khối lượng của proton và neutron đều xấp xỉ 1,0 amu, còn khối lượng electron nhỏ hơn rất nhiều (0,00055 amu) nên có thể coi nguyên tử khối xấp xỉ số khối của hạt nhân.
Ví dụ: Nguyên tử của nguyên tố potassium (K) có Z = 19; số neutron = 20 nên nguyên tử khối của K là 19 + 20 = 39.
2. Nguyên tử khối trung bình
Nguyên tử khối của một nguyên tố là nguyên tử khối trung bình (kí hiệu là \(\overline{A}\)) của hỗn hợp các đồng vị của nguyên tố đó.
Ví dụ: bằng phương pháp phổ khối lượng, người ta xác định được trong tự nhiên, nguyên tố chlorine có 2 đồng vị bền là \(^{35}_{17}Cl\) (chiếm 75,77%) và \(^{37}_{17}Cl\) (chiếm 24,23% số nguyên tử)
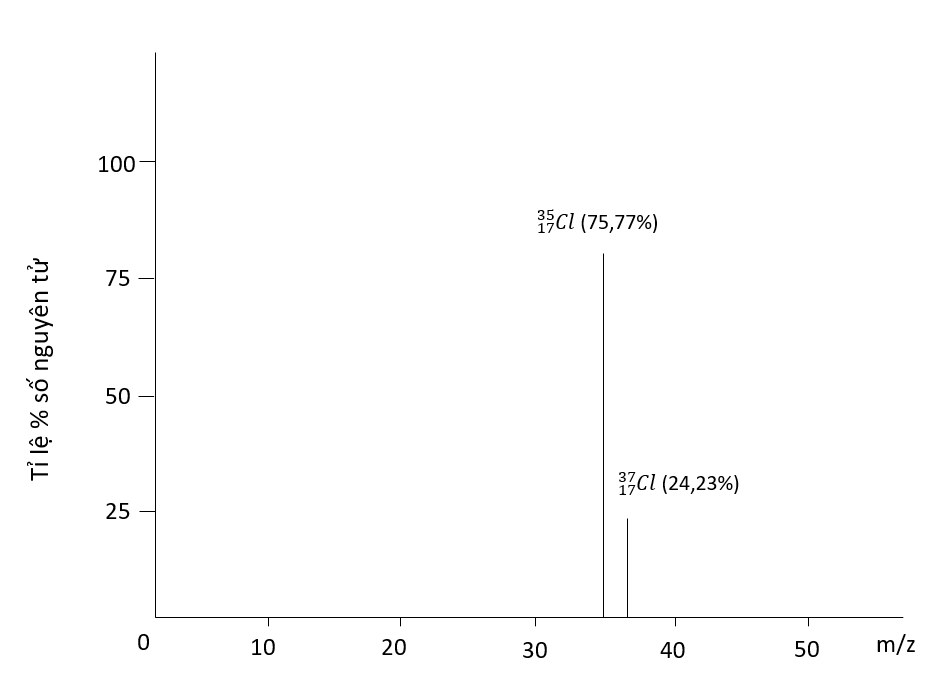
Phổ khối lượng của chlorine
Nguyên tử khối trung bình của chlorine:
\(\overline{A}=\dfrac{\left(75,77\times35\right)+\left(24.23\times37\right)}{100}=35.48\simeq35.5\)
@2014405@
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!
Danh sách các phiên bản khác của bài học này. Xem hướng dẫn
| Cherry đã đóng góp một phiên bản khác cho bài học này (18 tháng 7 2023 lúc 14:20) | 0 lượt thích |