Bài 18: Cấu tạo và liên kết trong tinh thể kim loại
Nội dung lý thuyết
I. Đặc điểm cấu tạo của nguyên tử kim loại
Trong cùng một chu kì, nguyên tử kim loại có điện tích hạt nhân nhỏ hơn và bán kính nguyên tử lớn hơn các nguyên tử phi kim nên dễ nhường electron hóa trị hơn và có độ âm điện nhỏ hơn.
II. Tinh thể kim loại
1. Tinh thể kim loại
- Ở nhiệt độ phòng, các đơn chất kim loại ở thể rắn và có cấu tạo tinh thể (trừ thủy ngân ở thể lỏng).
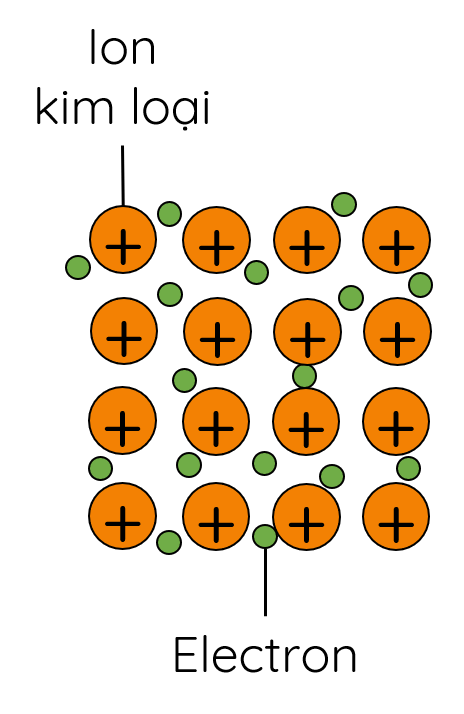
- Trong tinh thể kim loại, các ion dương kim loại nằm ở các nút mạng tinh thể và các electron hóa trị chuyển động tự do xung quanh.
- Các kiểu mạng tinh thể phổ biến của kim loại:
Kiểu mạng tinh thể | Mạng lập phương tâm khối | Mạng lập phương tâm mặt | Mạng lục phương chặt khít |
| Cấu trúc | 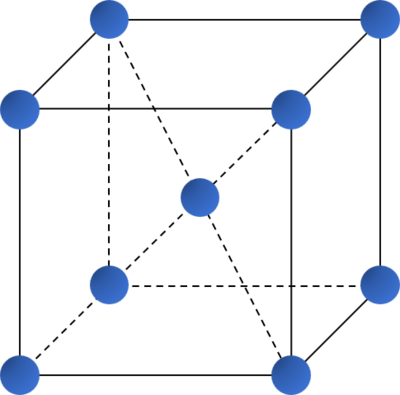 | 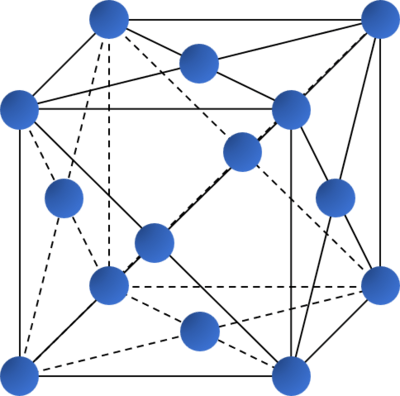 | 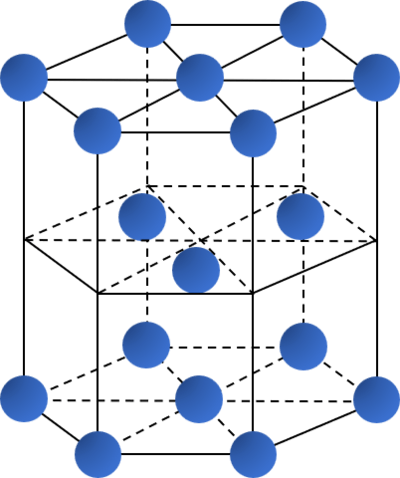 |
| Độ đặc khít (%) | 68 | 74 | 74 |
| Số phối trí | 8 | 12 | 12 |
| Ví dụ | Li, Na, K, Ba,... | Ca, Sr, Cu,... | Be, Mg,... |
2. Liên kết kim loại
Trong tinh thể kim loại, liên kết kim loại được hình thành do lực hút tĩnh điện giữa các electron hóa trị tự do với các ion dương kim loại ở các nút mạng.