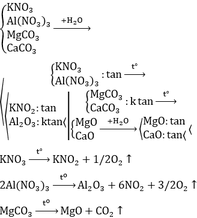Dùng nước có thể phân biệt MgCO3(s) và Mg(NO3)2(s) được không. Giải thích.

Những câu hỏi liên quan
Có các dung dịch không màu đựng trong các lọ riêng biệt, không dán nhãn: ZnSO4, Mg(NO3)2, Al(NO3)3. Để phân biệt các dung dịch trên có thể dùng: A. quỳ tím B. dung dịch NaOH C. dung dịch Ba(OH)2 D. dung dịch BaCl2
Đọc tiếp
Có các dung dịch không màu đựng trong các lọ riêng biệt, không dán nhãn: ZnSO4, Mg(NO3)2, Al(NO3)3. Để phân biệt các dung dịch trên có thể dùng:
A. quỳ tím
B. dung dịch NaOH
C. dung dịch Ba(OH)2
D. dung dịch BaCl2
Giải thích tại sao trong nước tự nhiên thường có lẫn những lượng nhỏ các muối Ca(NO3)2, Mg(NO3)2, Ca(HCO3)2, Mg(HCO3)2.
Hãy dùng một hóa chất để có thể loại đồng thời các muối trên khỏi nước.
Vì trong hình thành tự nhiên thành phần của đá có chứa nhiều CaCO3 và MgCO3. Khi mưa có nồng độ NO cao sẽ chuyển thành axit HNO3 hay mưa có nồng độ CO2 cao sẽ phản ứng chuyển hóa tạo nên những muối trên.
Ta dùng $Na_2CO_3$ để kết tủa hết và loại bỏ các cation làm nước cứng
Đúng 4
Bình luận (0)
+ Vì trong tự nhiên có sấm sét, mưa: N2+O2−−−−−−>2NO NO+1/2O2−−−−−−−−>NO2 2NO2+1/2O2+H2O−−−−−−−>2HNO3 + đá vôi có lẫn MgCO3 sẻ bị nước mưa hoà tan : CaCO3+2HNO3−>Ca(NO3)2+CO2+H2O MgCO3+2HNO3−−−−−−>Mg(NO3)2+CO2+H2O +Trong không khí có CO_2 nên : CaCO3+CO2+H2O−−−−−−−>Ca(HCO3)2 MgCO3+CO2+H2O−−−−−−−−−>Mg(HCO3)2
- để loại bỏ các muối trên ta dùng Na2CO3
Đúng 2
Bình luận (0)
Cho các phát biểu sau: (1) Nước cứng là nước có chứa nhiều cation Ca2+, Mg2+. (2) Để làm mất tính cứng vĩnh cửu của nước có thể dùng dung dịch Ca(OH)2 hoặc dung dịch Na3PO4. (3) Không thể dùng nước vôi để làm mềm nước cứng tạm thời. (4) Từ quặng đolomit có thể điều chế được kim loại Mg và Ca riêng biệt. (5) Các kim loại K, Ca, Mg, Al được điều chế bằng cách điện phân nóng chảy muối clorua của tương ứng. Số phát biểu đúng là A. 5 B. 3 C...
Đọc tiếp
Cho các phát biểu sau:
(1) Nước cứng là nước có chứa nhiều cation Ca2+, Mg2+.
(2) Để làm mất tính cứng vĩnh cửu của nước có thể dùng dung dịch Ca(OH)2 hoặc dung dịch Na3PO4.
(3) Không thể dùng nước vôi để làm mềm nước cứng tạm thời.
(4) Từ quặng đolomit có thể điều chế được kim loại Mg và Ca riêng biệt.
(5) Các kim loại K, Ca, Mg, Al được điều chế bằng cách điện phân nóng chảy muối clorua của tương ứng.
Số phát biểu đúng là
A. 5
B. 3
C. 2
D. 4
Cho các phát biểu sau: (1) Nước cứng là nước có chứa nhiều cation Ca2+, Mg2+. (2) Để làm mất tính cứng vĩnh cửu của nước có thể dùng dung dịch Ca(OH)2 hoặc dung dịch Na3PO4. (3) Không thể dùng nước vôi để làm mềm nước cứng tạm thời. (4) Từ quặng đolomit có thể điều chế được kim loại Mg và Ca riêng biệt. (5) Các kim loại K, Ca, Mg, Al được điều chế bằng cách điện phân nóng chảy muối clorua của tương ứng. Số phát biểu đúng là A. 5 B. 3 C. 2 D. 4
Đọc tiếp
Cho các phát biểu sau:
(1) Nước cứng là nước có chứa nhiều cation Ca2+, Mg2+.
(2) Để làm mất tính cứng vĩnh cửu của nước có thể dùng dung dịch Ca(OH)2 hoặc dung dịch Na3PO4.
(3) Không thể dùng nước vôi để làm mềm nước cứng tạm thời.
(4) Từ quặng đolomit có thể điều chế được kim loại Mg và Ca riêng biệt.
(5) Các kim loại K, Ca, Mg, Al được điều chế bằng cách điện phân nóng chảy muối clorua của tương ứng.
Số phát biểu đúng là
A. 5
B. 3
C. 2
D. 4
Cho các phát biểu sau: (1) Nước cứng là nước có chứa nhiều cation Ca2+, Mg2+. (2) Để làm mất tính cứng vĩnh cửu của nước có thể dùng dung dịch Ca(OH)2 hoặc dung dịch Na3PO4. (3) Không thể dùng nước vôi để làm mềm nước cứng tạm thời. (4) Từ quặng đolomit có thể điều chế được kim loại Mg và Ca riêng biệt. (5) Các kim loại K, Ca, Mg, Al được điều chế bằng cách điện phân nóng chảy muối clorua của tương ứng. Số phát biểu đúng là A. 5. B. 3. C. 2. ...
Đọc tiếp
Cho các phát biểu sau:
(1) Nước cứng là nước có chứa nhiều cation Ca2+, Mg2+.
(2) Để làm mất tính cứng vĩnh cửu của nước có thể dùng dung dịch Ca(OH)2 hoặc dung dịch Na3PO4.
(3) Không thể dùng nước vôi để làm mềm nước cứng tạm thời.
(4) Từ quặng đolomit có thể điều chế được kim loại Mg và Ca riêng biệt.
(5) Các kim loại K, Ca, Mg, Al được điều chế bằng cách điện phân nóng chảy muối clorua của tương ứng.
Số phát biểu đúng là
A. 5.
B. 3.
C. 2.
D. 4
(1) Nước cứng là nước có chứa nhiều cation Ca2+, Mg2+
(4) Từ quặng đolomit có thể điều chế được kim loại Mg và Ca riêng biệt.
Đáp án C
Đúng 0
Bình luận (0)
Cho các phát biểu sau: (a) Nước cứng là nước có chứa nhiều cation Ca2+, Mg2+. (b) Để làm mất tính cứng vĩnh cửu của nước có thể dùng dung dịch Ca(OH)2 hoặc dung dịch Na3PO4. (c) Không thể dùng nước vôi để làm mềm nước cứng tạm thời. (4) Từ quặng đolomit có thể điều chế được kim loại Mg và Ca riêng biệt. (5) Các kim loại K, Ca, Mg, Al được điều chế bằng cách điện phân nóng chảy muối clorua của tương ứng. Số phát biểu đúng là A. 5 B. 3 C. 2 D. 4
Đọc tiếp
Cho các phát biểu sau:
(a) Nước cứng là nước có chứa nhiều cation Ca2+, Mg2+.
(b) Để làm mất tính cứng vĩnh cửu của nước có thể dùng dung dịch Ca(OH)2 hoặc dung dịch Na3PO4.
(c) Không thể dùng nước vôi để làm mềm nước cứng tạm thời.
(4) Từ quặng đolomit có thể điều chế được kim loại Mg và Ca riêng biệt.
(5) Các kim loại K, Ca, Mg, Al được điều chế bằng cách điện phân nóng chảy muối clorua của tương ứng. Số phát biểu đúng là
A. 5
B. 3
C. 2
D. 4
Cho các phát biểu sau: (a) Nước cứng là nước có chứa nhiều cation Ca2+, Mg2+. (b) Để làm mất tính cứng vĩnh cửu của nước có thể dùng dung dịch Ca(OH)2 hoặc dung dịch Na3PO4. (c) Không thể dùng nước vôi để làm mềm nước cứng tạm thời. (d) Từ quặng đolomit có thể điều chế được kim loại Mg và Ca riêng biệt. (e) Các kim loại K, Ca, Mg, Al được điều chế bằng cách điện phân nóng chảy muối clorua của tương ứng. Số phát biểu đúng là: A. 5. B. 3. C. 2 D. 4
Đọc tiếp
Cho các phát biểu sau:
(a) Nước cứng là nước có chứa nhiều cation Ca2+, Mg2+.
(b) Để làm mất tính cứng vĩnh cửu của nước có thể dùng dung dịch Ca(OH)2 hoặc dung dịch Na3PO4.
(c) Không thể dùng nước vôi để làm mềm nước cứng tạm thời.
(d) Từ quặng đolomit có thể điều chế được kim loại Mg và Ca riêng biệt.
(e) Các kim loại K, Ca, Mg, Al được điều chế bằng cách điện phân nóng chảy muối clorua của tương ứng.
Số phát biểu đúng là:
A. 5.
B. 3.
C. 2
D. 4
Cho các phát biểu sau: (a) Nước cứng là nước có chứa nhiều cation Ca2+, Mg2+. (b) Để làm mất tính cứng vĩnh cửu của nước có thể dùng dung dịch Ca(OH)2 hoặc dung dịch Na3PO4. (c) Không thể dùng nước vôi để làm mềm nước cứng tạm thời. (d) Từ quặng đolomit có thể điều chế được kim loại Mg và Ca riêng biệt. (e) Các kim loại K, Ca, Mg, Al được điều chế bằng cách điện phân nóng chảy muối clorua của tương ứng. Số phát biểu đúng là: A. 5. B. 3. C. 2. D. 4.
Đọc tiếp
Cho các phát biểu sau:
(a) Nước cứng là nước có chứa nhiều cation Ca2+, Mg2+.
(b) Để làm mất tính cứng vĩnh cửu của nước có thể dùng dung dịch Ca(OH)2 hoặc dung dịch Na3PO4.
(c) Không thể dùng nước vôi để làm mềm nước cứng tạm thời.
(d) Từ quặng đolomit có thể điều chế được kim loại Mg và Ca riêng biệt.
(e) Các kim loại K, Ca, Mg, Al được điều chế bằng cách điện phân nóng chảy muối clorua của tương ứng.
Số phát biểu đúng là:
A. 5.
B. 3.
C. 2.
D. 4.
(a), (d) đúng ⇒ Chọn C
(b) sai vì Ca(OH)2 cung cấp thêm ion Ca2+.
(c) sai vì Ca(OH)2 có thể làm mềm được nước cứng tạm thời.
OH - + HCO 3 - → CO 3 2 - + H 2 O ; Ca 2 + + CO 3 2 - → CaCO 3 ↓
(e) Sai vì AlCl3 bị thăng hoa ở nhiệt độ cao nên không thể điện phân được AlCl3. Do đó để điều chế Al người ta điện phân nóng chảy Al2O3.
Đúng 0
Bình luận (0)
A/ Chỉ dùng một thuốc thử hãy phân biệt các dung dịch sau:
NaOH, CuSO4, Fe(NO3)3, Fe(NO3)2, NH4Cl, AlCl3
B/ Có 5 mẫu kim loại :Ba, Mg, Fe, Ag, Al chỉ dùng dung dịch H2SO4 loãng (không được dùng chất khác ). Hãy nhận biết ra 5 kim loại trên.
giúp mình với!!!!!!!
a. Cho dung dịch NaOH lần lượt vào các mẫu thử :
- Kết tủa xanh lam : CuSO4
- Kết tủa nâu đỏ : Fe(NO3)3
- Kết tủa trắng xanh , hóa nâu đỏ trong không khí : Fe(NO3)2
- Sủi bọt khí mùi khai : NH4Cl
- Kết tủa keo trắng , tan dần trong NaOH dư : AlCl3
- Không HT : NaOH
\(2NaOH+CuSO_4\rightarrow Na_2SO_4+Cu\left(OH\right)_2\)
\(3NaOH+Fe\left(NO_3\right)_3\rightarrow3NaNO_3+Fe\left(OH\right)_3\)
\(2NaOH+Fe\left(NO_3\right)_2\rightarrow2NaNO_3+Fe\left(OH\right)_2\)
\(NaOH+NH_4Cl\rightarrow NaCl+NH_3+H_2O\)
\(3NaOH+AlCl_3\rightarrow3NaCl+Al\left(OH\right)_3\)
\(NaOH+Al\left(OH\right)_3\rightarrow NaAlO_2+2H_2O\)
Đúng 1
Bình luận (0)
a, - Trích từng dung dịch làm mẫu thử và đánh số thứ tự .
- Chọn thuốc thử là dung dịch NaOH dư .
- Nhỏ vào từng mẫu thử .
+, Mẫu thử không hiện tượng là NaOH
+, Mẫu thử tạo kết tủa xanh lơ là CuSO4
PTHH : CuSO4 + 2NaOH -> Cu(OH)2 + Na2SO4
+, Mẫu thử tạo kết tủa nâu đỏ là Fe(NO3)3
PTHH : Fe(NO3)3 + 3NaOH -> 3NaNO3 + Fe(OH)3
+, Mẫu thử tạo kết tủa trắng xanh rồi hóa nâu đỏ trong không khí là Fe(NO3)2
Fe(NO3)2 + 2NaOH -> Fe(OH)2 + 2NaNO3
2Fe(OH)2 + O2 + H2O -> 2Fe(OH)3
+, Mẫu thử tạo khí mùi khai là NH4Cl
PTHH : NH4Cl + NaOH -> NaCl + NH3 + H2O
+, Mẫu thử tạo kết tủa keo rồi tan là AlCl3
3NaOH + AlCl3 -> Al(OH)3 + 3NaCl
Al(OH)3 + NaOH -> NaAlO2 + H2O
Đúng 1
Bình luận (0)
b.
Cho dung dịch H2SO4 loãng lần lượt vào từng chất :
- Tan , sủi bọt , tạo kết tủa trắng : Ba
- Tan , sủi bọt : Mg , Fe , Al
- Không tan : Ag
Cho Ba phản ứng đến dư với dung dịch H2SO4 => Lọc kết tủa , thu được dung dịch Ba(OH)2
Cho dung dịch Ba(OH)2 vào các dung dịch còn lại :
- Kết tủa trắng : chất ban đầu là : Mg
- Kết tủa trắng xanh , hóa nâu đỏ trong không khí : Fe
- Kết tủa keo trắng , tan dần : Al
PTHH em tự viết nhé !
Đúng 2
Bình luận (0)
Chỉ được dùng thêm nước và các thiết bị cần thiết (lò nung, đèn cồn…). Hãy trình bày cách phân biệt 4 chất bột màu trắng (tương tự nhau) đựng riêng biệt trong 4 lọ mất nhãn: KNO3, Al(NO3)3, MgCO3, CaCO3. Viết phương trình hóa học của các phản ứng xảy ra (ghi rõ điều kiện nếu có).