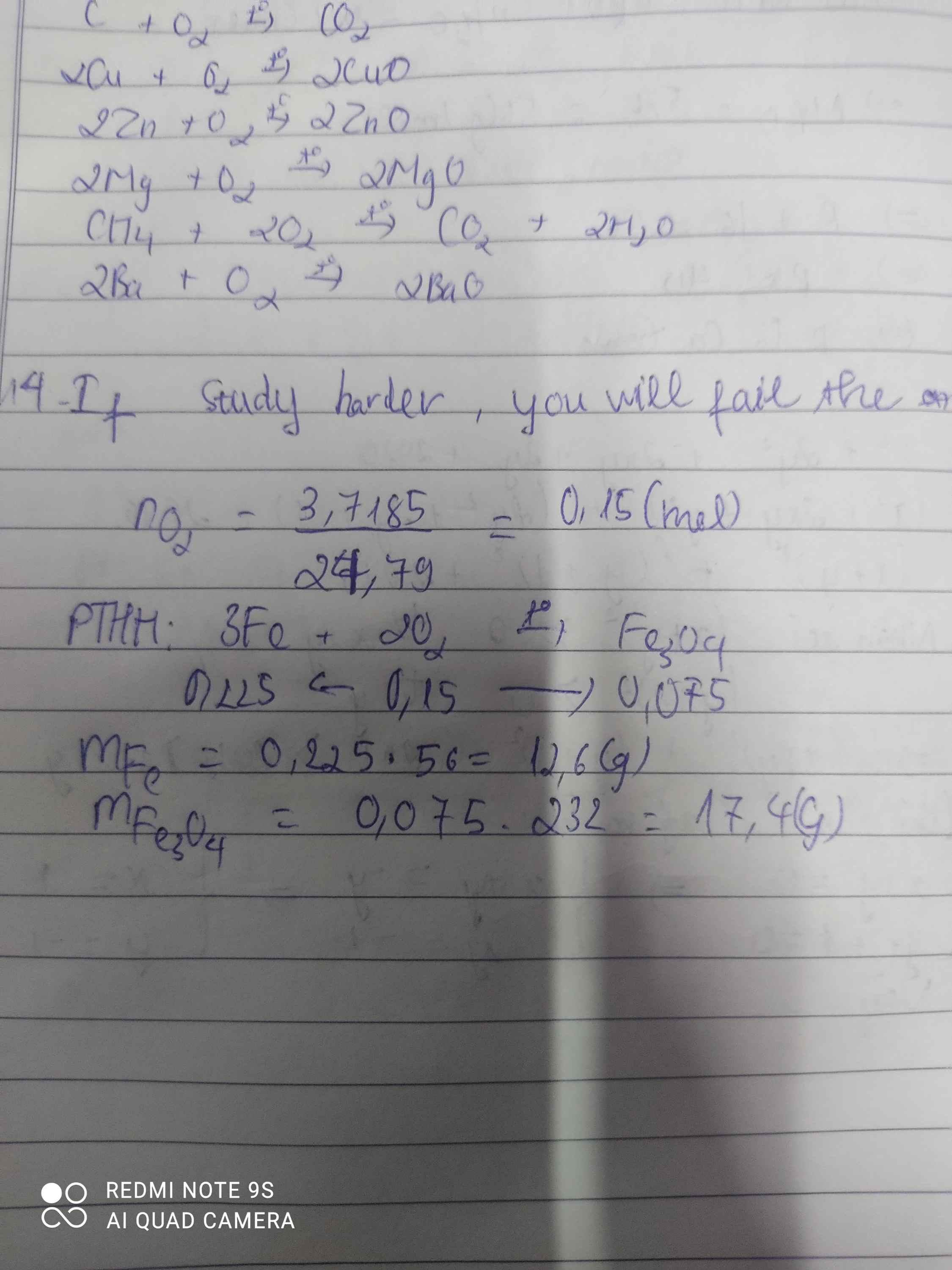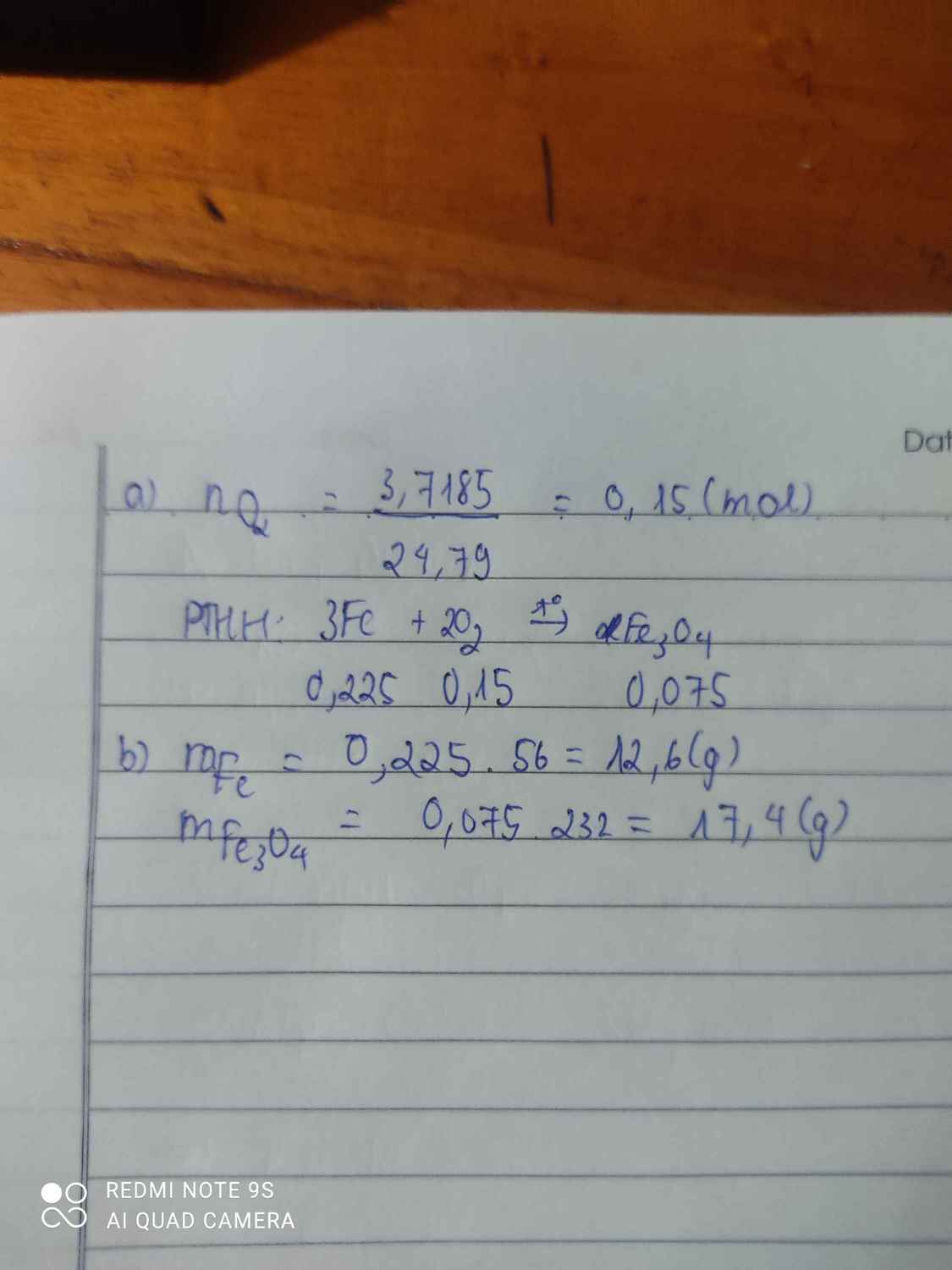Một số hợp chất phổ biến của nguyên tố sắt trong vỏ Trái Đất gồm: iron(II) oxide, iron(II) carbonate, iron(III) oxide, iron(II) sillicate và iron(II) disulfide. Trong các hợp chất trên có bao nhiêu oxiđe, bao nhiêu muối?

Những câu hỏi liên quan
Đốt cháy Iron trong lọ đựng 3,7185 lít khí Oxygen thu được Iron (II,III) Oxide.
Tính khới lượng Iron phản ứng và khối lượng Iron (II,III) Oxide thu được (Fe=56)
\(n_{O_2}=\dfrac{3,7185}{24,79}=0,15\left(mol\right)\\ 3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\\ n_{Fe}=\dfrac{3}{2}.n_{O_2}=1,5.0,15=0,225\left(mol\right)\\ \Rightarrow m_{Fe}=0,225.56=12,6\left(g\right)\\ n_{Fe_3O_4}=\dfrac{n_{O_2}}{2}=\dfrac{0,15}{2}=0,075\left(mol\right)\\ \Rightarrow m_{Fe_3O_4}=232.0,075=17,4\left(g\right)\)
Đúng 4
Bình luận (3)
Đốt cháy Iron trong lọ đựng 3,7185 lít khí Oxygen thu được Iron (II,III) oxide
a.Viết PTHH
b.Tính khối lượng Iron phản ứng và khối lượng Iron (II,III) oxide thu được (Fe=56)
3Fe+2O2-to>Fe3O4
0,225---0,15---0,075
n O2= \(\dfrac{3,7185}{24,79}\)=0,15 mol
=>m Fe=0,225.56=12,6g
=>m Fe3O4=0,075.232=17,4g
Đúng 3
Bình luận (0)
Để điều chế Iron(II, III) oxide, người ta đốt cháy Iron trong khí oxygen
a. Tính khối lượng Iron và thể tích khí Oxygen(điều kiện chuẩn) cần dùng để điều chế được 4,64 gam Iron(II, III) oxide
b. Cần bao nhiêu gam Potassium chlorate(KClO3) để điều chế ra lượng Oxygen cần dùng ở phản ứng trên?
3Fe+2O2-to>Fe3O4
0,06---0,04------0,02 mol
n Fe3O4=\(\dfrac{4,64}{232}\)=0,02 mol
=>m Fe=0,06.56=3,36g
=>VO2=0,04.22,4=0,896l
b)2KClO3-to>2KCl+3O2
\(\dfrac{2}{75}\)------------------0,04 mol
=>m KClO3=\(\dfrac{2}{75}\).122,5=32,67g
Đúng 3
Bình luận (0)
đốt cháy hoàn toàn 44,8g Fe trong khí Oxygen tạo thành Iron(II,III) oxide(Fe2O3)
a) viết phương trình
b) tính thể tích khí oxygen tham gia phản ứng ở đkc
c) tính khối lượng iron(II,III) oxide tạo thành
d) cần phân huỷ bao nhiêu gam thuốc tím(KMnO4) để có toàn bộ khí Oxygen cho phản ứng trên
4Fe+3O2-to>2Fe2O3
0,8-----0,6------0,4 mol
n Fe=\(\dfrac{44,8}{56}\)=0,8 mol
=>VO2=0,6.22,4=13,44l
=>m Fe2O3=0,4.160=64g
d) 2KMnO4-to>K2MnO4+MnO2+O2
1,2---------------------------------0,6
=>m KMnO4=1,2.158=189,6g
Đúng 2
Bình luận (0)
Cho 8,4 gam bột iron cháy trong 3,2 gam khí oxygen tạo ra x gam iron (II, III) oxide. Giá trị của x là:
Bảo toàn khối lượng: \(m_{Fe_3O_4}=m_{Fe}+m_{O_2}=11,6\left(g\right)\)
Đúng 0
Bình luận (2)
Đốt cháy 16,8 gam Iron thu được Iron (II,III) oxide
a)viết PTHH
b)tính thể tích của oxi cần dùng
c) tính khối lượng của Iron (II,III) oxide tạo thành
d) tính khối lượng thuốc tím cần dùng để điều khí oxyen cho phản ứng trên
a,
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
b, \(nFe=\dfrac{16,8}{56}=0,3\left(mol\right)\)
\(\Rightarrow nO_2=0,3.\dfrac{2}{3}=0,2\left(mol\right)\)
\(VO_2=0,2.24,79=4,958\left(l\right)\)
c, \(nFe_3O_4=0,1\left(mol\right)\)
\(mFe_3O_4=0,1.232=23,2\left(gam\right)\)
Đúng 2
Bình luận (0)
: Kim loại sắt (iron) có màu xám trắng có khối lượng 25,2g để lâu trong không khí tạo thành 34,8g oxit sắt từ (iron (II, III) oxide) Fe3O4 có màu nâu đỏ.a) Viết phương trình hóa học xảy rab) Viết biểu thức khối lượng của phản ứng trên. c) Tính khối lượng khí oxi tham gia phản ứng?C12, S 32, N 14, O 16 giúp mk vs
Đọc tiếp
: Kim loại sắt (iron) có màu xám trắng có khối lượng 25,2g để lâu trong không khí tạo thành 34,8g oxit sắt từ (iron (II, III) oxide) Fe3O4 có màu nâu đỏ.
a) Viết phương trình hóa học xảy ra
b) Viết biểu thức khối lượng của phản ứng trên.
c) Tính khối lượng khí oxi tham gia phản ứng?
C=12, S= 32, N= 14, O =16
giúp mk vs
\(a.PTHH:3Fe+2O_2\overset{t^o}{--->}Fe_3O_4\)
b. \(m_{Fe}+m_{O_2}=m_{Fe_3O_4}\)
c. Thay các đại lượng vào b, ta được:
\(25,2+m_{O_2}=34,8\)
\(\Leftrightarrow m_{O_2}=34,8-25,2=9,6\left(g\right)\)
Đúng 3
Bình luận (0)
Bài 7: 29,2 gam hỗn hợp gồm sắt (iron) và iron (II) oxide phản ứng vừa đủ với 200 ml dung dịch HCl nồng độ x (M), thấy thoát ra 4,958 lít khí (đkc) và thu được dung dịch A.a. Tính % khối lượng mỗi chất trong hỗn hợp đầu.b. Tính x. Bài 8: Cho 8,8 gam hỗn hợp gồm magnesium và magnesium oxide phản ứng hết với 400 ml dung dịch hydrochloric acid 2M. Sau phản ứng thu được 4,958 lít khí không màu, không mùi (đkc) và dung dịch A.a. Tính % khối lượng mỗi chất trong hỗn hợp.b. Xác định thành...
Đọc tiếp
Bài 7: 29,2 gam hỗn hợp gồm sắt (iron) và iron (II) oxide phản ứng vừa đủ với 200 ml dung dịch HCl nồng độ x (M), thấy thoát ra 4,958 lít khí (đkc) và thu được dung dịch A.
a. Tính % khối lượng mỗi chất trong hỗn hợp đầu.
b. Tính x.
Bài 8: Cho 8,8 gam hỗn hợp gồm magnesium và magnesium oxide phản ứng hết với 400 ml dung dịch hydrochloric acid 2M. Sau phản ứng thu được 4,958 lít khí không màu, không mùi (đkc) và dung dịch A.
a. Tính % khối lượng mỗi chất trong hỗn hợp.
b. Xác định thành phần và tính nồng độ mol của dung dịch A, biết thể tích dung dịch thay đổi không đáng kể.
Tính khối lượng dd silver nitrate nồng độ 20% cần dùng để phản ứng hết với dd A.
Nhận biết các chất rắn sau bằng phương pháp hóa học: barium oxide (BaO), dinitrogen pentoxide (N2O5), iron (II) oxide (FeO), potassium oxide (K2O).
Đốt cháy 50,4 gam kim loại iron (sắt) trong không khí thu được m gam iron (II, III) oxide. Giá trị của m là: ( Fe=56, O=16) a. 69,6 gam b. 6,96 gam c. 20,88 gam d. 208,8 gam
\(n_{Fe}=\dfrac{50,4}{56}=0,9\left(mol\right)\\ PTHH:3Fe+2O_2\rightarrow^{t^o}Fe_3O_4\\ \Rightarrow n_{Fe_3O_4}=\dfrac{n_{Fe}}{3}=0,3\left(mol\right)\\ \Rightarrow m_{Fe_3O_4}=0,3\cdot232=69,6\left(g\right)\)
Đúng 1
Bình luận (0)
nFe = 0,9 (mol)
3Fe + 2O2 --to--> Fe3O4
nFe3o4 = nfe/3 =0,3 (mol)
=> mFe3o4 = 0,3.232 = 69,6 (g) => A
Đúng 0
Bình luận (0)