Làm thế nào để xác định có khí CO2 tạo ra khi đốt cháy ethylene?

Những câu hỏi liên quan
Đốt cháy 30,9875 (lít) khí Ethylene (25độ C,1bar)
a) Viết Phương trình hóa học
b) Thể tích khí Oxi (25 độ C,1 bar) cần cho phản ứng cháy nói trên
c) khi cho khí Ethylene tác dụng với nước có acid làm chất xúc thu được rượu Ethanol.Tính khối lượng rượu Ethylene tạo thành.biết hiệu suất phản ứng là 80%
\(a,n_{C_2H_4}=\dfrac{30,9875}{24,79}=1,25\left(mol\right)\)
PTHH: C2H4 + 3O2 --to--> 2CO2 + 2H2O
1,25--->3,75
b, \(V_{O_2}=3,75.24,79=92,9625\left(l\right)\)
c, PTHH: C2H4 + H2O --axit--> C2H5OH
1,25--------------------->1,25
\(\Rightarrow m_{C_2H_5OH}=1,25.80\%.46=46\left(g\right)\)
Đúng 2
Bình luận (0)
Chất A là một đồng đẳng của benzen. Khi đốt cháy hoàn toàn 1,5 g chất A, người ta thu được 2,52 lít khí
C
O
2
( ở đktc ).1. Xác định công thức phân tử chất A.2. Viết các công thức cấu tạo có thể có của A kèm theo tên tương ứng.3. Khi A tác dụng với
B
r
2
có chất xúc tác Fe và nhiệt độ thì một nguyên tử H đính với vòng benzen bị thay thế bởi Br, tạo ra dẫn xuất monobrom duy nhất. Xác định côn...
Đọc tiếp
Chất A là một đồng đẳng của benzen. Khi đốt cháy hoàn toàn 1,5 g chất A, người ta thu được 2,52 lít khí C O 2 ( ở đktc ).
1. Xác định công thức phân tử chất A.
2. Viết các công thức cấu tạo có thể có của A kèm theo tên tương ứng.
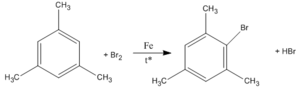
3. Khi A tác dụng với B r 2 có chất xúc tác Fe và nhiệt độ thì một nguyên tử H đính với vòng benzen bị thay thế bởi Br, tạo ra dẫn xuất monobrom duy nhất. Xác định công thức cấu tạo đúng của A.
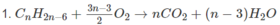
Cứ ( 14n - 6) g A tạo ra n mol C O 2
Cứ 1,50 g A tạo ra 
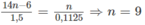
Công thức phân tử của A là C 9 H 12
2. Các công thức cấu tạo
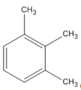 (1,2,3-trimetylbenzen )
(1,2,3-trimetylbenzen )
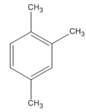 (1,2,4-trimetylbenzen)
(1,2,4-trimetylbenzen)
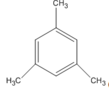 (1,3,5-trimetylbenzen)
(1,3,5-trimetylbenzen)
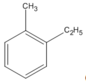 (1-etyl-2-metylbenzen)
(1-etyl-2-metylbenzen)
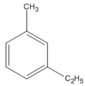 (1-etyl-3-metylbenzen)
(1-etyl-3-metylbenzen)
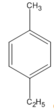 (1-etyl-4-metylbenzen)
(1-etyl-4-metylbenzen)
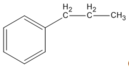 (propylbenzen)
(propylbenzen)
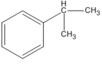 (isopropylbenzen)
(isopropylbenzen)
3. 
Đúng 0
Bình luận (0)
1/ Đốt cháy hoàn toàn 9,2 gam một hợp chất hữư cơ A, sau phản ứng tạo ra 17,6 gam CO2 và 10,8 gam H2O.a) Xác định công thức phân tử của A. Biết tỉ khối hơi của A so với khí hiđro là 23.b) Viết các công thức cấu tạo có thể có của A.2/ Đốt cháy hoàn toàn 1 lít khí hiđrocacbon cần 6 lít khí oxi, sinh ra 4 lít khí cacbonic. Các thể tích khí đo ở cùng nhiệt độ và áp suất.a) Xác định công thức phân tử của hiđrocacbon.b) Viết các công thức cấu tạo có thể có của hiđrocacbon đó.
Đọc tiếp
1/ Đốt cháy hoàn toàn 9,2 gam một hợp chất hữư cơ A, sau phản ứng tạo ra 17,6 gam CO2 và 10,8 gam H2O.
a) Xác định công thức phân tử của A. Biết tỉ khối hơi của A so với khí hiđro là 23.
b) Viết các công thức cấu tạo có thể có của A.
2/ Đốt cháy hoàn toàn 1 lít khí hiđrocacbon cần 6 lít khí oxi, sinh ra 4 lít khí cacbonic. Các thể tích khí đo ở cùng nhiệt độ và áp suất.
a) Xác định công thức phân tử của hiđrocacbon.
b) Viết các công thức cấu tạo có thể có của hiđrocacbon đó.
1) Bảo toàn C: \(n_C=\dfrac{17,6}{44}=0,4\left(mol\right)\)
Bảo toàn H: \(n_H=\dfrac{10,8}{18}.2=1,2\left(mol\right)\)
Bảo toàn O: \(n_O=\dfrac{9,2-0,4.12-1,2}{16}=0,2\left(mol\right)\)
\(M_A=23.2=46\left(\dfrac{g}{mol}\right)\)
CTPT: CxHyOz
=> x : y : z = 0,4 : 1,2 : 0,2 = 2 : 6 : 1
=> (C2H6O)n = 46
=> n = 1
CTPT: C2H6O
CTCT:
(1) CH3-CH2-OH
(2) CH3-O-CH3
2) Ta có:
\(V_{C_xH_y}:V_{O_2}:V_{CO_2}=1:6:4\)
=> \(n_{C_xH_y}:n_{O_2}:n_{CO_2}=1:6:4\)
Bảo toàn C: \(x=n_C=n_{CO_2}=4\left(mol\right)\)
Bảo toàn O: \(n_{O\left(H_2O\right)}=2n_{O_2}-2n_{CO_2}=2.6-2.4=4\left(mol\right)\)
Bảo toàn H: \(n_H=2n_{H_2O}=2n_{O\left(H_2O\right)}=2.4=8\left(mol\right)\)
=> Trong 1 mol A chứa 4 mol C và 8 mol H
=> CTPT: C4H8
CTCT:
(1) CH2=CH-CH2-CH3
(2) CH3-CH=CH-CH3
Đúng 5
Bình luận (0)
Đốt cháy 1,15g chất hữu cơ A thủ được 2,2g CO2 và 1,35g H2O.biết A có tỉ khối đối với khí hiđro là 23 a)trong A có những nguyên tố nào? b)xác định công thức cấu tạo phân tử A.Viết công thức cấu tạo của A c)tính khối lượng của A để điều chế được 120g dụng dịch axit axetic chứa 5% axit axetic,biết hiệu suất là 92%
\(n_C=n_{CO_2}=\dfrac{2.2}{44}=0.05\left(mol\right)\)
\(n_{H_2O}=\dfrac{1.35}{18}=0.075\left(mol\right)\Rightarrow n_H=0.075\cdot2=0.15\left(mol\right)\)
\(m_O=1.15-0.05\cdot12-0.15=0.4\left(g\right)\)
\(n_O=\dfrac{0.4}{16}=0.025\left(mol\right)\)
\(CT:C_xH_yO_z\)
\(x:y:z=0.05:0.15:0.025=2:6:1\)
\(CTnguyên:\left(C_2H_6O\right)_n\)
\(M_A=23\cdot2=46\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow46n=46\)
\(\Rightarrow n=1\)
\(CT:C_2H_6O\)
\(CTCT:\)
\(CH_3-CH_2-OH\)
\(CH_3-O-CH_3\)
\(n_{CH_3COOH}=\dfrac{120\cdot5}{100\cdot60}=0.1\left(mol\right)\)
\(C_2H_5OH+O_2\underrightarrow{^{\text{men giấm}}}CH_3COOH+H_2O\)
\(0.1........................................0.1\)
\(n_{C_2H_5OH\left(tt\right)}=\dfrac{0.1}{92\%}=\dfrac{5}{46}\left(mol\right)\)
\(m_{C_2H_5OH}=\dfrac{5}{46}\cdot46=5\left(g\right)\)
Đúng 2
Bình luận (1)
Chỉ ra dấu hiệu cho thấy đã có phản ứng hóa học xảy ra. Hãy viết phương trình chữ của phản ứng và xác định chất phản ứng, sản phẩm của các phản ứng.
Khi đốt nến (làm bằng parafin), nến cháy trong không khí (tác dụng với oxygen) tạo ra khí carbon dioxide và hơi nước.Chỉ ra dấu hiệu cho thấy đã có phản ứng hóa học xảy ra. Hãy viết phương trình chữ của phản ứng và xác định chất phản ứng, sản phẩm của các phản ứng.
Đọc tiếp
Chỉ ra dấu hiệu cho thấy đã có phản ứng hóa học xảy ra. Hãy viết phương trình chữ của phản ứng và xác định chất phản ứng, sản phẩm của các phản ứng.
Khi đốt nến (làm bằng parafin), nến cháy trong không khí (tác dụng với oxygen) tạo ra khí carbon dioxide và hơi nước.Chỉ ra dấu hiệu cho thấy đã có phản ứng hóa học xảy ra. Hãy viết phương trình chữ của phản ứng và xác định chất phản ứng, sản phẩm của các phản ứng.
Giúp em với ạ! Đốt cháy hoàn toàn một hidrocacbon Z bằng oxi dư thu được 8.96l khí CO2 (đkc) và 5.4g nước.A. Hidrocacbon Z thuộc dãy đồng đẳng nào? Xác định CTPTB. Viết các công thức cấu tạo của Z. Trong các cấu tạo của Z em hãy chọn ra chất phản ứng được với dung dịch AgNO3/NH3 tạo kết tủa vàng và gọi tên nó.C.Tính lượng kết tủa thu được khi cho Z phản ứng với dung dịch AgNO3/NH3
Đọc tiếp
Giúp em với ạ! Đốt cháy hoàn toàn một hidrocacbon Z bằng oxi dư thu được 8.96l khí CO2 (đkc) và 5.4g nước.
A. Hidrocacbon Z thuộc dãy đồng đẳng nào? Xác định CTPT
B. Viết các công thức cấu tạo của Z. Trong các cấu tạo của Z em hãy chọn ra chất phản ứng được với dung dịch AgNO3/NH3 tạo kết tủa vàng và gọi tên nó.
C.Tính lượng kết tủa thu được khi cho Z phản ứng với dung dịch AgNO3/NH3
Đốt cháy 2,479 lít khí Ethylene(Ethene-C2H4)
a.Cần dùng hết bao nhiêu lít khí Oxygen
b.Với cùng lượng khí oxygen nói trên nếu dùng để đốt cháy khí acetylene(Ethyne-C2H2) thì có thể đốt cháy hoàn toàn đc bao nhiu lít C2H2?
(các chất khí đc đo ở 25 độ c,1 bar)
a, nC2H4 = 2,479/24,79 = 0,1 (mol)
PTHH: C2H4 + 3O2 -> (t°) 2CO2 + 2H2O
Mol: 0,1 ---> 0,3
VO2 = 0,3 . 24,79 = 7,437 (l)
b, PTHH: 2C2H2 + 5O2 -> (t°) 4CO2 + 2H2O
Mol: 0,12 <--- 0,3
VC2H2 = 0,12 . 24,79 = 2,9748 (l)
Đúng 3
Bình luận (0)
Nhận xét nào sau đây là sai?A. Khi đốt cháy hoàn toàn một ankan trong oxi, số mol
H
2
O
tạo ra lớn hơn số mol
C
O
2
.B. Khi đốt cháy hoàn toàn một hiđrocacbon trong oxi, nếu số mol
H
2
O
tạo thành lớn hơn số mol
C
O
2
thì hiđrocacbon đó là ankan.C. Các ankan có thể tham gia phản ứng thế.D...
Đọc tiếp
Nhận xét nào sau đây là sai?
A. Khi đốt cháy hoàn toàn một ankan trong oxi, số mol H 2 O tạo ra lớn hơn số mol C O 2 .
B. Khi đốt cháy hoàn toàn một hiđrocacbon trong oxi, nếu số mol H 2 O tạo thành lớn hơn số mol C O 2 thì hiđrocacbon đó là ankan.
C. Các ankan có thể tham gia phản ứng thế.
D. Nếu một hiđrocacbon có thể tham gia phản ứng thế thì hiđrocacbon là ankan.
Biết X là hợp chất hữu cơ chứa (C,H,O) có công thức phân tử trùng với công thức đơn giản nhất . Cho 2,85 gam X tác dụng hết với H2O (có xúc tác H2SO4,nhiệt độ ) , phản ứng tạo ra 2 hợp chất hữu cơ Y ,Z . Đôt cháy hết lượng Y ở trên thu được 2,016 lít khí CO2 và 1,62 gam hơi H2O Khi đốt cháy lượng Z ở trên thu được 0,672 lít CO2 và 0,81 gam hơi H2O Tổng lượng O2 tiêu tốn cho hai phản ứng cháy trên đúng bằng lượng O2 tạo ra khi nhiệt phân hoàn toàn 42,66 gam KMnO4 . Thể tích các khí đó...
Đọc tiếp
Biết X là hợp chất hữu cơ chứa (C,H,O) có công thức phân tử trùng với công thức đơn giản nhất . Cho 2,85 gam X tác dụng hết với H2O (có xúc tác H2SO4,nhiệt độ ) , phản ứng tạo ra 2 hợp chất hữu cơ Y ,Z . Đôt cháy hết lượng Y ở trên thu được 2,016 lít khí CO2 và 1,62 gam hơi H2O
Khi đốt cháy lượng Z ở trên thu được 0,672 lít CO2 và 0,81 gam hơi H2O
Tổng lượng O2 tiêu tốn cho hai phản ứng cháy trên đúng bằng lượng O2 tạo ra khi nhiệt phân hoàn toàn 42,66 gam KMnO4 . Thể tích các khí đó ở đktc
1. Xác định công thức phân tử của X
2.Nếu biết X tác dụng với Na giải phóng H2 và My=90g/mol . Xác định công thức cấu tạo có thể có X,Y
Đốt cháy hoàn toàn a gam ankan A thu được 3,36 lít khí CO2 (đktc) và 3,6 gam H2O
a) Xác định CTPT của A
b) Tính a
c) Viết ptpu xảy ra khi cho A tác dụng với khí Cl2 ( tỉ lệ 1:1, trong điều kiện có as )
a)
\(n_{CO_2} = \dfrac{3,36}{22,4} = 0,15(mol)\\ n_{H_2O} = \dfrac{3,6}{18} = 0,2(mol)\\ \Rightarrow n_A = 0,2 - 0,15 = 0,05(mol)\)
Số nguyên tử Cacbon = \(\dfrac{n_{CO_2}}{n_A} = \dfrac{0,15}{0,05} = 3\)
Vậy A là \(C_3H_8\)
b) a = 0,05.44 = 2,2(gam)
c)
\(CH_3-CH_2-CH_3 + Cl_2 \xrightarrow{as} CH_3-CHCl-CH_3 + HCl\\ CH_3-CH_2-CH_3 + Cl_2 \xrightarrow{as} CH_2Cl-CH_2-CH_3 + HCl\)
Đúng 2
Bình luận (0)














