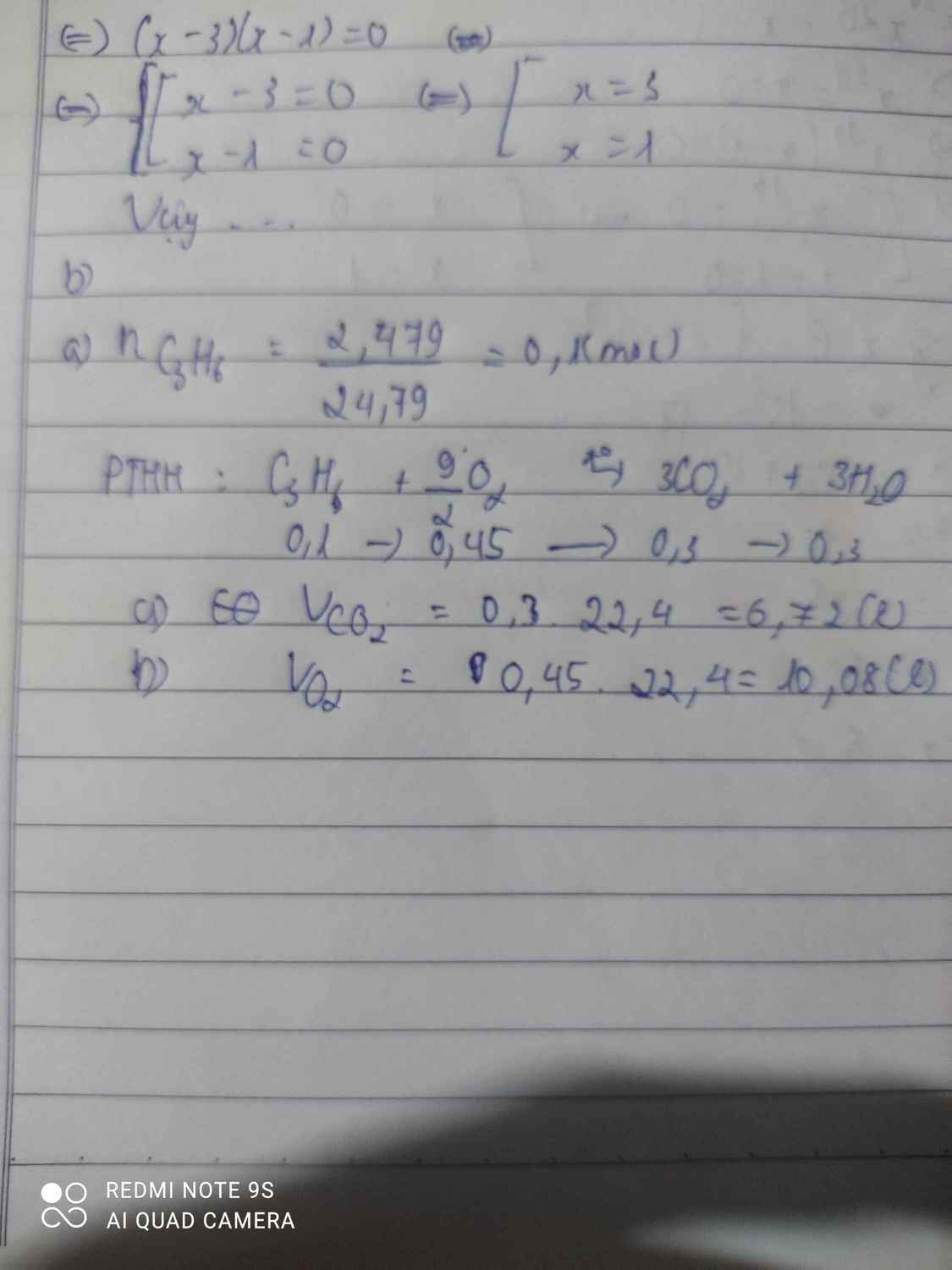Đốt cháy hoàn toàn 2,479 lit khí CO thu đc khí CO2. Tính thể tích khí O2 cần dùng các khí đó ở đkc

Những câu hỏi liên quan
Đốt cháy hoàn toàn một hỗn hợp khí gồm có CO và H2 cần dùng 6,72 lit khí O2. Khí sinh ra có 4,48 lit khí CO2. Hãy tính thành phần % của hỗn hợp khí ban đầu theo thể tích hỗn hợp( các thể tích khí đều đo ở cùng đktc)
\(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ n_{CO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH:
2CO + O2 --to--> 2CO2
0,2<---0,1<--------0,2
2H2 + O2 --to--> 2H2O
0,4<--0,2<-------0,2
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CO}=\dfrac{0,2}{0,2+0,4}.100\%=33,33\%\\\%V_{H_2}=100\%-33,33\%=66,67\%\end{matrix}\right.\)
Đúng 1
Bình luận (0)
\(n_{CO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: 2CO + O2 --to--> 2CO2
0,3<--0,15<------0,3
2H2 + O2 --to--> 2H2O
0,1<--0,05
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CO}=\%n_{CO}=\dfrac{0,3}{0,3+0,1}.100\%=75\%\\\%V_{H_2}=100\%-75\%=25\%\end{matrix}\right.\)
đốt cháy 2,479 lít propane trong khí oxygen (đkc) thì thu được khí carbonic và hơi nước
a. Tính thể tích khí CO2 thu được.
b. Tính thể tích khí oxygen cần dùng.
n C3H8=0,1 mol
C3H8+5O2-to>3CO2+4H2O
0,1-----0,5------------0,3-----0,4 mol
=>VCO2=0,3.22,4=6,72 l
=>VO2=0,5.22,4=11,2l
Đúng 3
Bình luận (0)
Sau khi kết thúc phản ứng cracking butan thu 22,4 lit hỗn hợp khí X (giả sử chỉ gồm các hiđrocacbon). Cho X lội từ từ qua dung dịch brom dư thì chỉ còn 13,44 lit hỗn hợp khí Y. Đốt cháy hoàn toàn 0,6 lit hỗn hợp khí Y thu được 1,3 lit CO2. Các thể tích khí đều đo ở đktc. Thể tích khí O2 cần để đốt cháy hoàn toàn Y là A. 50,4 lit B. 45,6 lít C. 71,68 lít D. 67,2 lít
Đọc tiếp
Sau khi kết thúc phản ứng cracking butan thu 22,4 lit hỗn hợp khí X (giả sử chỉ gồm các hiđrocacbon). Cho X lội từ từ qua dung dịch brom dư thì chỉ còn 13,44 lit hỗn hợp khí Y. Đốt cháy hoàn toàn 0,6 lit hỗn hợp khí Y thu được 1,3 lit CO2. Các thể tích khí đều đo ở đktc. Thể tích khí O2 cần để đốt cháy hoàn toàn Y là
A. 50,4 lit
B. 45,6 lít
C. 71,68 lít
D. 67,2 lít
Đáp án A
Crackinh butan → 1 mol hhX.
X đi qua brom dư thì còn 13,44 lít hhY. Đốt cháy 0,6 lít hhY → 1,3 lít CO2.
• Đốt cháy 0,6 lít hhY gồm các ankan thu được 1,3 lít CO2
→ Đốt cháy 13,44 lít hhY thì thu được:
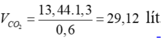
Vì hhY gồm ankan
→ VH2O = VCO2 + Vankan = 13,44 + 29,12 = 42,56 lít.
Theo BTNT O: VO2 = (2 x VCO2 + VH2O) : 2
= (29,12 x 2 + 42,56) : 2 = 50,4 lít
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 1 hỗn hợp khí gồm CO và H2 cần dùng 6,72L O2 . Khí sinh ra có 4,48L khí CO2 . Biết các khí ở ĐKTC . Tính thành phần trăm theo thể tích của các khí trong hỗn hợp
nO2(tổng)=0,3(mol); nCO2=0,2(mol)
CO + 1/2 O2 -to-> CO2 (1)
0,2<----0,1<-------0,2(mol)
H2 + 1/2 O2 -to-> H2O (2)
0,4<---0,2<-------0,4(mol)
nO2(2)= nO2(tổng)- nO2(1)=0,3-0,1=0,2(mol)
Vì số mol tỉ lệ thuận thể tích:
=> %V(CO/hh)= [0,2/(0.2+0,4)].100=33,333%
=>%V(H2/hh)=100%-33,333%=66,667%
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn V(lit) khi thiên nhiên ( có chứa 90% CH4 :5% C2H4,và 5% C2H8) cần dùng vừa đủ 246,4lit không khí ( có chứa 80% N2 và 20% O2) thu được khí CO2 và H2O
a) Tìm V?
b) Tính thể tích hỗn hợp khí thu được sau phản ứng
Biết các khí được đo ở cùng điều kiện về nhiệt độ và áp suất.
a) Giả sử các khí được đo ở điều kiện sao cho 1 mol khí chiếm thể tích 1 lít
Gọi số mol hỗn hợp khí là a (mol) => \(\left\{{}\begin{matrix}n_{CH_4}=0,9a\left(mol\right)\\n_{C_2H_4}=0,05a\left(mol\right)\\n_{C_3H_8}=0,05a\left(mol\right)\end{matrix}\right.\)
\(n_{O_2}=\dfrac{246,4.20\%}{1}=49,28\left(mol\right)\)
=> \(n_{N_2}=\dfrac{246,4}{1}-49,28=197,12\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
0,9a->1,8a---->0,9a--->1,8a
C2H4 + 3O2 --to--> 2CO2 + 2H2O
0,05a->0,15a------>0,1a-->0,1a
C3H8 + 5O2 --to--> 3CO2 + 4H2O
0,05a-->0,25a----->0,15a-->0,2a
=> 1,8a + 0,15a + 0,25a = 49,28
=> a = 22,4 (mol) => V = 22,4.1 = 22,4 (l)
b) Sau phản ứng thu được \(\left\{{}\begin{matrix}N_2:197,12\left(mol\right)\\CO_2:25,76\left(mol\right)\\H_2O:47,04\left(mol\right)\end{matrix}\right.\)
- Nếu H2O ở thể lỏng
=> hh khí gồm N2, CO2
=> \(V_{hh}=\left(197,12+25,76\right).1=222,88\left(l\right)\)
- Nếu H2O ở thể khí
=> hh gồm N2, CO2, H2O
=> \(V_{hh}=\left(197,12+25,76+47,04\right).1=269,92\left(l\right)\)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 8,96 lít khí H2 trong bình O2.Sau 1 thời gian thu được hơi nước bám vào thành bình. a.Viết PTHH? b.Tính thể tích O2 cần dùng?Tính thể tích không khí cần thiết để có lượng khí O2 trên ?(đkc)
\(a.2H_2+O_2-^{t^o}\rightarrow2H_2O\\ b.n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\\ n_{O_2}=\dfrac{1}{2}n_{H_2}=0,2\left(mol\right)\\ \Rightarrow V_{O_2}=0,2.22,4=4,48\left(l\right)\\ TrongkhôngkhíO_2chiếm20\%\\ \Rightarrow V_{kk}=\dfrac{4,48}{20\%}=22,4\left(l\right)\)
Đúng 2
Bình luận (0)
đốt cháy hoàn toàn 11,2 lit khí methane hãy tính khí oxygen cần dùng và thể tích khí carbonic tạo thành ( ở đkc 25°C , 1bar ) xin có giải thích , vì sao luôn ạ
\(n_{CH_4}=\dfrac{V}{22,4}=\dfrac{11,2}{22,4}=0,5mol\)
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
0,5 1 0,5 ( mol )
\(V_{O_2}=n.24,79=1.24,79=24,79l\)
\(V_{CO_2}=n.24,79=0,5.24,79=12,395l\)
Đúng 6
Bình luận (0)
nCH4 = 11,2/22,4 = 0,5 (mol)
PTHH: CH4 + 2O2 -> (t°) CO2 + 2H2O
Mol: 0,5 ---> 1
VO2 = 1 . 24,79 = 24,79 (l)
Đúng 4
Bình luận (0)
nCH4 = 11,2/22,4 = 0,5 (mol)
PTHH: CH4 + 2O2 -> (t°) CO2 + 2H2O
Mol: 0,5 ---> 1
VO2 = 1 . 24,79 = 24,79 (l)
Đúng 1
Bình luận (0)
Câu 5. Đốt cháy hoàn toàn 5,6 lit hỗn hợp khí metan và etilen cần phải dùng vừa đủ 13,44 lit khí oxi.
a) Tính phần trăm thể tích mỗi khí trong hỗn hợp.
b) Tính thể tích khí CO2 sinh ra.
(Cho biết: C = 12, H = 1. Các thể tích khí đo ở đktc).
CH4+2O2-to>CO2+2H2O
x------2x---------x
C2H4+3O2-to>2CO2+2H2O
y----------3y--------2y
=>\(\left\{{}\begin{matrix}x+y=\dfrac{5,6}{22,4}\\2x+3y=\dfrac{13,44}{22,4}\end{matrix}\right.\)
=>x=0,15 mol , y=0,1 mol
=>%VCH4=\(\dfrac{0,15.22,4}{5,6}\).100=60%
=>%VC2H4=100-60=40%
b)
VCO2=(0,15+0,1.2).22,4=7,84l
Đúng 4
Bình luận (2)
mhh khí = 5,6/22,4 = 0,25 (mol)
nO2 = 13,44/22,4 = 0,6 (mol)
Gọi nC2H4 = a (mol); nCH4 = b (mol)
a + b = 0,25 (1)
PTHH:
C2H4 + 3O2 -> (t°) 2CO2 + 2H2O
Mol: a ---> 3a ---> 2a
CH4 + 2O2 -> (t°) CO2 + 2H2O
Mol: b ---> 2b ---> b
3a + 2b = 0,6 (2)
(1)(2) => a = 0,1 (mol); b = 0,15 (mol)
%VC2H4 = 0,1/0,25 = 40%
%VCH4 = 100% - 40% = 60%
VCO2 = (0,1 . 2 + 0,15) . 22,4 = 7,84 (l)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 11,2 lit khí etilen ( C2H4 ) tạo ra sản phẩm CO2 và H2O
a) tính thể tích khí oxi cần dùng ở phản ứng trên
b) tính thể tích không khí cần dùng, biết khí oxi chiếm ⅕ thể tích không khí. Biết thể tích khi ở điều kiện tiêu chuẩn
a, \(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
Ta có: \(n_{C_2H_4}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
Theo PT: \(n_{O_2}=3n_{C_2H_4}=1,5\left(mol\right)\Rightarrow V_{O_2}=1,5.22,4=33,6\left(l\right)\)
b, \(V_{kk}=\dfrac{V_{O_2}}{20\%}=168\left(l\right)\)
Đúng 1
Bình luận (0)