Calcium và fluorine kết hợp thành phân tử calcium fluorine, CaF2. Trong đó, nguyên tử nào đã nhường và nhường bao nhiêu electron? Nguyên tử nào đã nhận và nhận bao nhiêu electron?

Những câu hỏi liên quan
Trong các phản ứng hóa học, để chuyển thành anion, nguyên tử của các nguyên tố halogen đã nhận hay nhường bao nhiêu electron
A. nhận thêm 1 electron
B. nhận thêm 2 electron
C. nhường đi 1 electron
D. nhường đi 7 electron
Nguyên tử nguyên tố nào sau đây có xu hướng nhường đi 1 electron khi hình thành liên kết hóa học?
A. Boron
B. Potassium
C. Helium
D. Fluorine
- Cấu hình electron B (Z = 5): 1s22s22p1 => Có 3 electron ở lớp ngoài cùng => Xu hướng nhường đi 3 electron
- Cấu hình electron K (Z = 19): 1s22s22p63s23p64s1 => Có 1 electron ở lớp ngoài cùng => Xu hướng nhường đi 1 electron
- Cấu hình electron He (Z = 2): 1s2 => Đạt cấu hình bền vững
- Cấu hình electron F (Z = 9): 1s22s22p5 => Có 7 electron ở lớp ngoài cùng => Xu hướng nhận thêm 1 electron
=> Nguyên tử nguyên tố Potassium (K, Z = 19) có xu hướng nhường đi 1 electron khi hình thành liên kết hóa học
Đáp án B
Đúng 0
Bình luận (0)
Nguyên tử nitrogen và nguyên tử nhôm có xu hướng nhận hay nhường lần lượt bao nhiêu electron để đạt được cấu hình electron bền vững?
A. Nhận 3 electron, nhường 3 electron
B. Nhận 5 electron, nhường 5 electron
C. Nhường 3 electron, nhận 3 electron
D. Nhường 5 electron, nhận 5 electron
- Cấu hình nguyên tử nitrogen (Z = 7): 1s22s22p3
=> Có 5 electron ở lớp vỏ ngoài cùng => Có xu hướng nhận thêm 3 electron để đạt cấu hình electron khí hiếm
- Cấu hình nguyên tử nhôm (Z = 13): 1s22s22p63s23p1
=> Có 3 electron ở lớp vỏ ngoài cùng => Có xu hướng nhường đi 3 electron để đạt cấu hình electron khí hiếm
Đáp án A
Đúng 0
Bình luận (0)
Trong các phản ứng hoá học, để chuyển thành anion, nguyên tử của các nguyên tố halogen đã nhận hay nhường bao nhiêu electron ? A. Nhận thêm 1 electron. B. Nhận thêm 2 electron. C. Nhường đi 1 electron. D. Nhường đi 7 electron.
Đọc tiếp
Trong các phản ứng hoá học, để chuyển thành anion, nguyên tử của các nguyên tố halogen đã nhận hay nhường bao nhiêu electron ?
A. Nhận thêm 1 electron.
B. Nhận thêm 2 electron.
C. Nhường đi 1 electron.
D. Nhường đi 7 electron.
Chọn đáp án A
Các nguyên tử nguyên tố halogen có 7 electron ở lớp ngoài cùng. Để đạt cấu hình electron bền vững của khí hiếm, chúng dễ nhận thêm 1e để tạo thành anion.
Đúng 0
Bình luận (0)
Trong các phản ứng hóa học, để chuyển thành anion, nguyên tử của các nguyên tố Halogen đã nhận hay nhường bao nhiêu electron A. Nhận thêm 1e B. Nhận thêm 2e C. Nhường đi 1e D. Nhường đi 7e
Đọc tiếp
Trong các phản ứng hóa học, để chuyển thành anion, nguyên tử của các nguyên tố Halogen đã nhận hay nhường bao nhiêu electron
A. Nhận thêm 1e
B. Nhận thêm 2e
C. Nhường đi 1e
D. Nhường đi 7e
Để chuyển thành anion mang điện tích âm, nguyên tử của các nguyên tố nhóm halogen nhận thêm electron (do có 7 e lớp ngoài cùng).
Đúng 0
Bình luận (0)
Khi kim loại kết hợp với phi kim thành hợp chất, electron di chuyển từ nguyên tử kim loại sang nguyên tử phi kim. Số electron các nguyên tử kim loại cho đi phải đúng bằng số electron các nguyên tử phi kim nhận được. Khi một nguyên tử nhận thêm electron hay nhường bớt electron, nó trở thành ion. Mô hình sau biểu diễn nguyên tử liti, nguyên tử nito và ion trong hợp chất liti nitrua. Xác định điện tích của ion liti, ion nito và công thức phân tử của hợp chất liti nitrua
Đọc tiếp
Khi kim loại kết hợp với phi kim thành hợp chất, electron di chuyển từ nguyên tử kim loại sang nguyên tử phi kim. Số electron các nguyên tử kim loại cho đi phải đúng bằng số electron các nguyên tử phi kim nhận được. Khi một nguyên tử nhận thêm electron hay nhường bớt electron, nó trở thành ion. Mô hình sau biểu diễn nguyên tử liti, nguyên tử nito và ion trong hợp chất liti nitrua.

Xác định điện tích của ion liti, ion nito và công thức phân tử của hợp chất liti nitrua
Liti mất 1e (3 – 1 = 2) lớp ngoài cùng nên ion Li mang điện tích +1
Nito thêm 3e (5 + 3 = 8) lớp ngoài cùng nên ion N mang điện tích –5 (N–5)
Công thức phân tử Li3N
Đúng 0
Bình luận (0)
Phát biểu nào dưới đây phù hợp với sơ đồ phản ứng ở Hình 10.1?
(1) Nguyên tử Na nhường, nguyên tử Cl nhận electron để trở thành các ion
(2) Nguyên tử Na và Cl góp chung electron để trở thành các ion
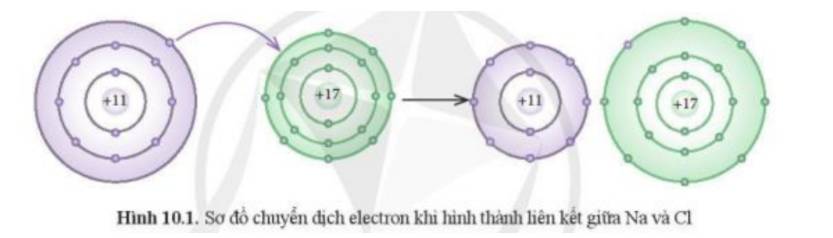
- Theo Hình 10.1 ta thấy:
+ Kim loại Na có 1 electron ở lớp vỏ ngoài cùng => Xu hướng nhường đi 1 electron để đạt cấu hình khí hiếm
+ Phi kim Cl có 7 electron ở lớp vỏ ngoài cùng => Xu hướng nhận thêm 1 electron để đạt cấu hình khí hiếm
=> Cl đã nhận thêm 1 electron từ Na để trở thành các ion
=> Phát biểu (1) phù hợp với sơ đồ phản ứng ở Hình 10.1
Đúng 0
Bình luận (0)
Nguyên tử fluorine (F) có cấu hình electron là [He]2s22p5. Khi các nguyên tử F liên kết với nhau, để thỏa mãn quy tắc octet, một bạn học sinh đề xuất như sau: Một nguyên tử F nhường 7 electron, tạo ion F7+ có cấu hình là [He]; 7 nguyên tử F khác, mỗi nguyên tử nhận 1 electron tạo 7 ion F- có cấu hình [Ne]. Sau đó 8 ion này hút nhau tạo thành chất có công thức (F7+)(F-)7. Vì sao đề xuất này không hợp lí trong thực tế? Hãy mô tả sự hình thành liên kết trong phân tử F2.
Đọc tiếp
Nguyên tử fluorine (F) có cấu hình electron là [He]2s22p5. Khi các nguyên tử F liên kết với nhau, để thỏa mãn quy tắc octet, một bạn học sinh đề xuất như sau: Một nguyên tử F nhường 7 electron, tạo ion F7+ có cấu hình là [He]; 7 nguyên tử F khác, mỗi nguyên tử nhận 1 electron tạo 7 ion F- có cấu hình [Ne]. Sau đó 8 ion này hút nhau tạo thành chất có công thức (F7+)(F-)7. Vì sao đề xuất này không hợp lí trong thực tế? Hãy mô tả sự hình thành liên kết trong phân tử F2.
- Cấu hình electron của F (Z = 9): 1s22s22p5
- Đề xuất của bạn học sinh không hợp lí trong thực tế vì:
+ Fluorine là nguyên tử có độ âm điện lớn nên khả năng nhận 1 electron dễ hơn nhường 7 electron.
+ Hai nlguyên tử F có độ âm điện bằng nhau nên không hình thành được liên kết ion như công thức (F7+)(F-)7 mà chỉ tạo được liên kết cộng hóa trị không cực.
- Sự hình thành liên kết trong phân tử F2:
Để đạt cấu hình của khí hiếm gần nhất, mỗi nguyên tử F đều cần thêm 1 electron. Vì vậy mỗi nguyên tử N cùng góp 1 electron để tạo nên 1 cặp electron chung cho 2 nguyên tử N.

⟹ Hai nguyên tử F liên kết với nhau bằng liên kết cộng hóa trị không cực tạo phân tử F2:
F - F
Đúng 0
Bình luận (0)
Tính phi kim được đặc trưng bằng khả năng nhận electron. Xu hướng cơ bản của nguyên tử O và F trong các phản ứng hóa học là nhường hay nhận bao nhiêu electron.
- Ta có: O và F đều là phi kim => Xu hướng cơ bản của nguyên tử O và F trong phản ứng hóa học là nhận electron
- Cấu hình electron O (Z = 8): 1s22s22p4 => Có 6 electron ở lớp vỏ ngoài cùng => Xu hướng nhận 2 electron
- Cấu hình electron F (Z = 9): 1s22s22p5=> Có 7 electron ở lớp vỏ ngoài cùng => Xu hướng nhận 1 electron
Đúng 0
Bình luận (0)




