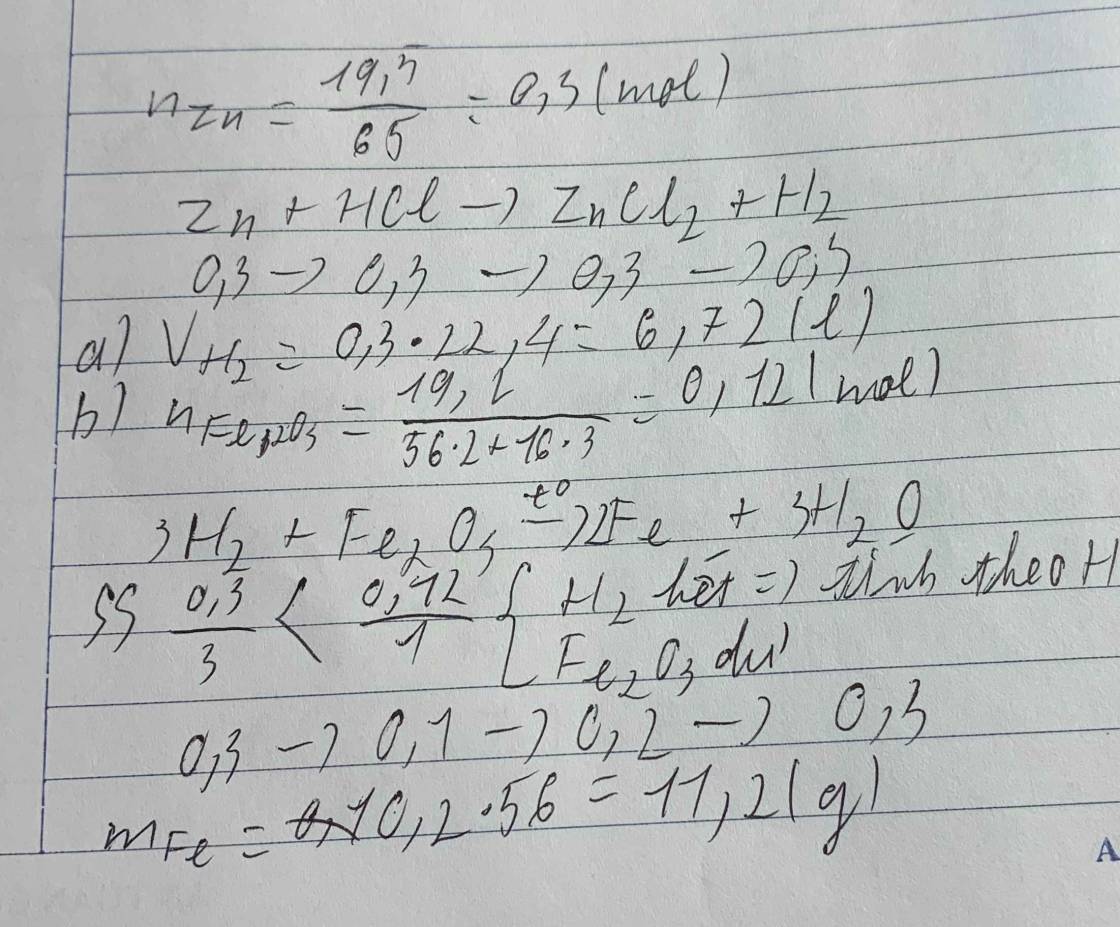Cho19,5gam znic tác dụng với hydrocloric acid a: tính thể tích (đktc) b:nếu dùng khí trên khử 19,2 gam iron(III) axit thì mIron =?

Những câu hỏi liên quan
Cho19,5gam znic tác dụng với hydrocloric acid a: tính thể tích (đkc) b:nếu dùng khí trên khử 19,2 gam iron(II) oxit thì mIron =?
Câu a tính V của cái gì á bạn?
Đúng 0
Bình luận (3)
https://hoc24.vn/cau-hoi/cho195gam-znic-tac-dung-voi-hydrocloric-acid-a-tinh-the-tich-dktc-bneu-dung-khi-tren-khu-192-gam-ironiii-axit-thi-miron.8559162182169
mik trl rồi bạn nhé!
Đúng 0
Bình luận (2)
a,
Số mol của Zn có trong pứ là:
\(\text{n}_{\text{Zn}}=\dfrac{\text{m}_{\text{Zn}}}{\text{M}_{\text{Zn}}}=\dfrac{19,5}{65}=0,3\left(\text{mol}\right)\)
PTHH: \(\text{Zn}+2\text{HCl}\longrightarrow\text{ZnCl}_2+\text{H}_2\)
Theo pt: 1 : 2 : 1 : 1
`=>` n của H2 sau pứ là `0,3` mol
Thể tích của H2 ở đkc là:
\(\text{V}_{\text{H}_2}=\text{n}_{\text{H}_2}\cdot24,79=0,3\cdot24,79=7,437\left(l\right)\)
b,
PTHH: \(\text{FeO}+\text{H}_2\) \(\underrightarrow{\text{ }\text{ t}^0\text{ }\text{ }}\) \(\text{Fe}+\text{H}_2\text{O}\)
n của FeO có trong pứ là:
\(n_{FeO}=\dfrac{m_{FeO}}{M_{FeO}}=\dfrac{19,2}{56+16}=\dfrac{19,2}{72}=\dfrac{4}{15}\left(\text{mol}\right)\)
Xét tỉ lệ:
\(\dfrac{0,3}{1}< \dfrac{4}{\dfrac{15}{1}}\Rightarrow\text{ H}_2\text{ dư}\)
Theo pt: 1 : 1
`=>` n của Fe sau pứ trên là `4/15` mol
Khối lượng của Fe sau pứ là:
\(\text{m}_{\text{Fe}}=\text{n}_{\text{Fe}}\cdot\text{M}_{\text{Fe}}=\dfrac{4}{15}\cdot56=\dfrac{224}{15}\approx14,93\left(\text{g}\right).\)
Đúng 1
Bình luận (1)
Cho 19,5 g kẽm tác dụng hết với dung dịch axit clohiđric. a. Tính thể tích khí H2 sinh ra (ở đktc). b. Nếu dùng thể tích H2 trên để khử 19,2 g sắt (III) oxit ở nhiệt độ cao thì thu được bao nhiêu gam sắt
Cho 19,5 gam kẽm tác dụng hết với dung dịch axit Clohiđric. Hãy tính :
A.thể tích khí hiđro sinh ra(đktc)
B.nếu dùng thể tích khí hiđro trên để khử 19,2 gam sắt(3) oxit thì thu đc bao nhiêu gam sắt?
\(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
PTHH :
\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
0,3 0,3
\(a,V_{H_2}=0,3.22,4=6,72\left(l\right)\)
\(b,PTHH:\)
\(3H_2+Fe_2O_3\underrightarrow{t^o}2Fe+3H_2O\)
trc p/u: 0,3 0,12
p/u: 0,3 0,1 0,2 0,3
sau : 0 0,02 0,2 0,3
----> Fe2O3 dư
\(n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12\left(mol\right)\)
\(n_{Fe}=0,2.56=11,2\left(g\right)\)
Đúng 2
Bình luận (0)
Bài 13: Cho 5,4 gam aluminium (Al) tác dụng với H2SO4
a. Tính thể tích khí H2 sinh ra (đkc )
b. Nếu dùng thể tích khí H2 thu được trên để khử iron (III) oxide (Fe2O3) thì thu được bao nhiêu gam iron (sắt)?
Bài 13:
a) \(n_{H_2}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
0,2---------------------------->0,3
=> VH2 = 0,3.24,79 = 7,437 (l)
b)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,3------->0,2
=> mFe = 0,2.56 = 11,2 (g)
Đúng 8
Bình luận (0)
Bài 13: Cho 5,4 gam aluminium (Al) tác dụng với H2SO4
a. Tính thể tích khí H2 sinh ra (đkc )
b. Nếu dùng thể tích khí H2 thu được trên để khử iron (III) oxide (Fe2O3) thì thu được bao nhiêu gam iron (sắt)?
a.\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,2 0,3 ( mol )
\(V_{H_2}=0,3.24,79=7,437l\)
b.\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
0,3 0,2 ( mol )
\(m_{Fe}=0,2.56=11,2g\)
Đúng 5
Bình luận (1)
tk
Bài 13:
a) nH2=5,4/27=0,2(mol)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
0,2---------------------------->0,3
=> VH2 = 0,3.24,79 = 7,437 (l)
b)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,3------->0,2
=> mFe = 0,2.56 = 11,2 (g)
Bài 1. Cho 19,5g zinc tác dụng hết với dung dịch hydrochloric acid HCl
a. Tính thể tích khí H2 sinh ra (đkc)
b. Nếu dùng thể tích khí H2 trên để khử 19,2g iron (III) oxide thì thu được bao nhiêu game iron?
Bài 2. Cho 9,2g Na vào nước dư thì thu được NaOH và khí H2. Tính thể tích khí H2 (đkc) thoát ra và khối lượng NaOH tạo thành?
Bài 1:
a, \(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Theo PT: \(n_{H_2}=n_{Zn}=0,3\left(mol\right)\Rightarrow V_{H_2}=0,3.24,79=7,437\left(l\right)\)
b, \(n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12\left(mol\right)\)
PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Xét tỉ lệ: \(\dfrac{0,12}{1}>\dfrac{0,3}{3}\), ta được Fe2O3 dư.
Theo PT: \(n_{Fe}=\dfrac{2}{3}n_{H_2}=0,2\left(mol\right)\Rightarrow m_{Fe}=0,2.56=11,2\left(g\right)\)
Đúng 0
Bình luận (0)
Bài 2:
Ta có: \(n_{Na}=\dfrac{9,2}{23}=0,4\left(mol\right)\)
PT: \(2Na+2H_2O\rightarrow2NaOH+H_2\)
Theo PT: \(n_{H_2}=\dfrac{1}{2}n_{Na}=0,2\left(mol\right)\Rightarrow V_{H_2}=0,2.24,79=4,958\left(l\right)\)
\(n_{NaOH}=n_{Na}=0,4\left(mol\right)\Rightarrow m_{NaOH}=0,4.40=16\left(g\right)\)
Đúng 0
Bình luận (1)
cho 19,5g kẽm tác dụng hết với dung dịch HCl.
a,Tính thể tích khí H2 thu được
b,nếu dùng thể tích khí H2 trên để khử 19,2 sắt (III)oxit thì thu được bao nhiêu gam
PTHH: Zn + 2HCl → ZnCl2 + H2 ↑
Số mol của Zn là: 19,5 : 65 = 0,3 mol
Số mol của H2 là: 0,3 . 1 = 0,3 mol
a) Thể tích H2 thu được là: 0,3 . 22,4 = 6,72 lít
b) PTHH: Fe2O3 + 3H2 → 2Fe + 3H2O
Số mol của Fe2O3 là: 19,2 : 160 = 0,12 mol
So sánh: \(\frac{0,3}{3}< 0,12\) => Fe2O3 dư, tính theo H2
Số mol của Fe là: 0,3 . 2/3 = 0,2 mol
Khối lượng Fe là: 0,2 . 56 = 11,2 gam
Đúng 2
Bình luận (0)
nZn=19,5:65=0,3mol
PTHH: Zn+2HCl=>ZnCl2+H2
0,3->0,6->0,3->0,3
=> V H2=0,3.22,4=6,72ml
thu đc bao nhiêu gam j
Đúng 1
Bình luận (0)
Xem thêm câu trả lời
Cho 19,5g kẽm tác dụng hết với dung dịch axit clohiđric. Hãy cho biết: a. Tính thể tích khí H2 (đktc) thu được b. Nếu dùng thể tích khí H2 trên để khử 19,2g sắt (III) oxit thì thu được bao nhiêu gam sắt? (Giúp em với ạ)
\(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\\
pthh:Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,3 0,3
\(V_{H_2}=0,3.22,4=6,72l\\ n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12g\\ pthh:Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\\ LTL:\dfrac{0,12}{1}>\dfrac{0,3}{3}\)
=> Fe2O3 dư
\(n_{Fe}=\dfrac{2}{3}n_{H_2}=0,2\left(mol\right)\\
m_{Fe}=0,2.56=11,2g\)
Đúng 2
Bình luận (1)
a.\(n_{Zn}=\dfrac{19,5}{65}=0,3mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,3 0,3 ( mol )
\(V_{H_2}=0,3.22,4=6,72l\)
b.\(n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12mol\)
\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
0,12 > 0,3 ( mol )
0,3 0,2 ( mol )
\(m_{Fe}=0,2.56=11,2g\)
Đúng 2
Bình luận (0)
Cho 6g magie tác dụng với axit sunfuric.
a/ Hãy cho biết thể tích khí hiđro sinh ra ở đktc.
b/ Nếu dùng thể tích khí hiđro trên để khử 32g sắt(III) oxit thì thu được bao nhiêu gam sắt?