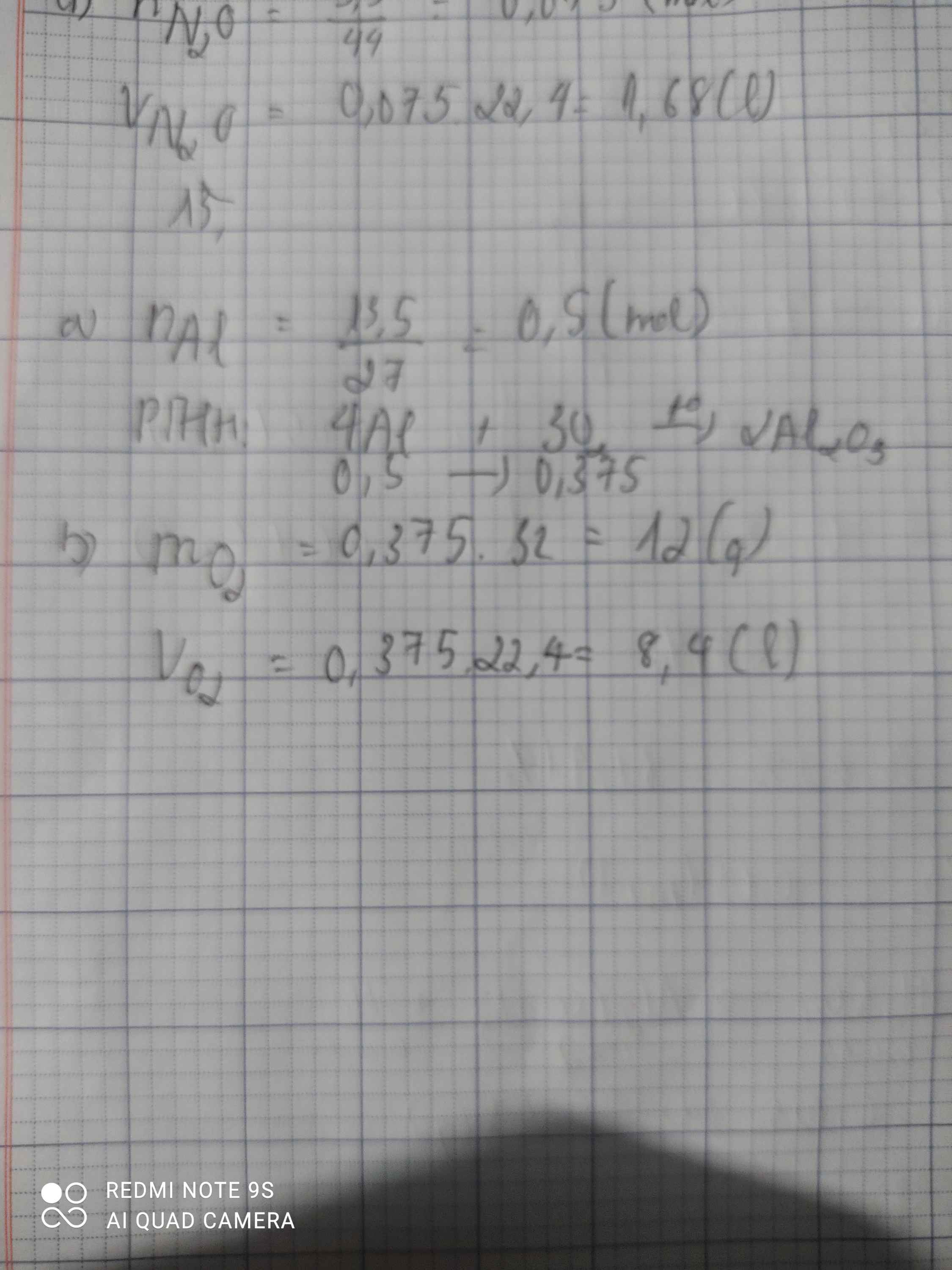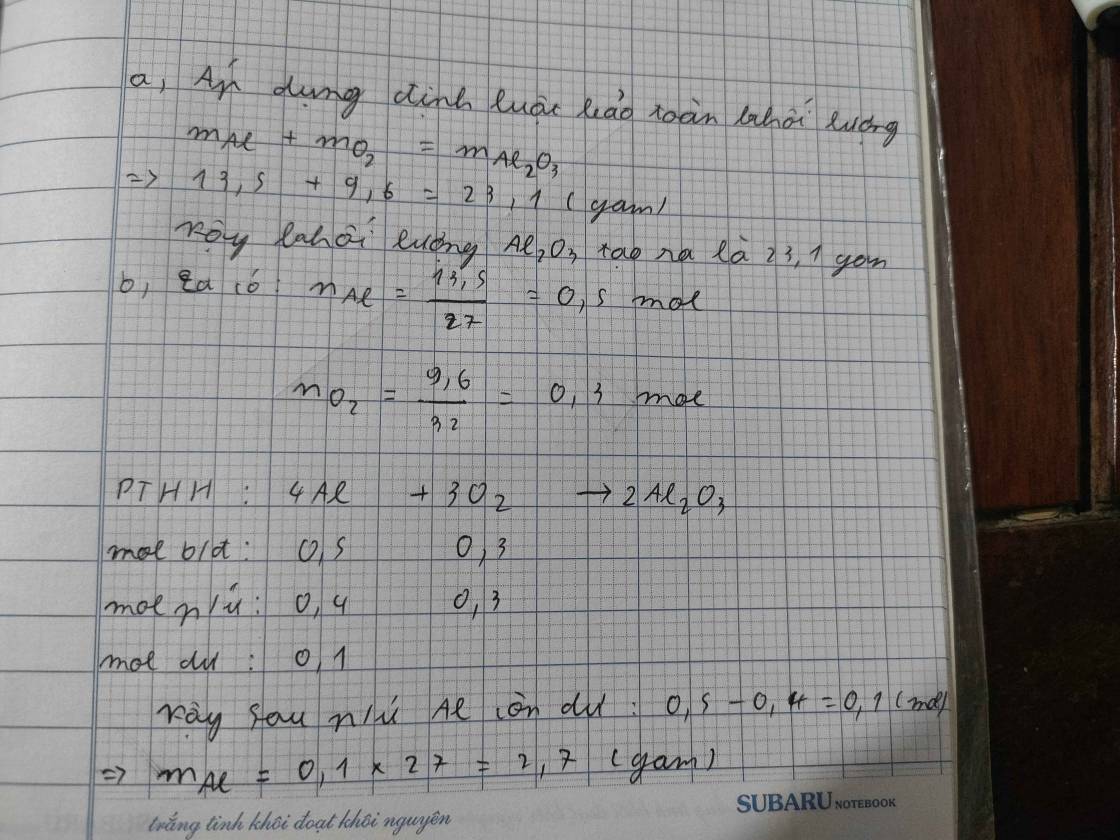cho S,P,N2,C,Al Viết phương trình phản ứng với O2 cho Al tác dụng với 3,2 (g) O2 sinh ra 10,2 g một chất .tính mal T/G phản ứng

Những câu hỏi liên quan
cho Al tác dụng với 3,2 (g) O2 sinh ra 10,2 g một chất .tính mal T/G phản ứng
\(n_{O_2}=\dfrac{3,2}{32}=0,1\left(mol\right)\)
\(n_{Al_2O_3}=\dfrac{10,2}{102}=0,1\left(mol\right)\)
PTHH :
\(4Al+3O_2\rightarrow2Al_2O_3\)
2/15 0,1 1/15
\(\dfrac{0,1}{3}< \dfrac{0,1}{2}\)
---> Tính theo O2
\(m_{Al}=\dfrac{2}{15}.27=3,6\left(g\right)\)
Đúng 1
Bình luận (0)
Cho 13,5 g kim loại al tác dụng với o2 sinh ra nhôm axit a) viết phản ứng hóa học b) tính khối lượng và thể tích của oxi tham gia phản ứng
\(n_{Al}=\dfrac{13,5}{27}=0,5\left(mol\right)\\a, 4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ n_{O_2}=\dfrac{3}{4}.0,5=0,375\left(mol\right)\\ m_{O_2}=32.0,375=12\left(g\right)\\ V_{O_2\left(đktc\right)}=0,375.22,4=8,4\left(l\right)\)
Đúng 3
Bình luận (3)
5,4 g Al tác dụng với O2 .Viết phương trình phản ứng .Tính khối lượng sản phẩm.
11,2 g Fe tác dụng với không khí( điều kiện chuẩn )tạo sắt từ oxit .Viết phương trình phản ứng tính thể tích của không khí (điều kiện chuẩn), khối lượng sản phẩm. Tính m Fe và O2 cần
\(n_{Al}=\dfrac{5.4}{27}=0.2\left(mol\right)\)
\(4Al+3O_2\underrightarrow{^{^{t^0}}}2Al_2O_3\)
Ta có :
\(n_{Al_2O_3}=\dfrac{0.2\cdot2}{4}=0.1\left(mol\right)\)
\(m_{Al_2O_3}=0.1\cdot102=10.2\left(g\right)\)
Đúng 3
Bình luận (0)
\(n_{Fe}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
\(3Fe+2O_2\underrightarrow{^{^{t^0}}}Fe_3O_4\)
\(0.2.......\dfrac{2}{15}.....\dfrac{1}{15}\)
\(V_{O_2}=\dfrac{2}{15}\cdot22.4=2.98\left(l\right)\)
\(m_{Fe_3O_4}=\dfrac{1}{15}\cdot232=15.46\left(g\right)\)
Đúng 2
Bình luận (0)
Cho 13,5 g Al tác dụng với 9,6 g O2, tạo ra Al2O3.
a) Tính khối lượng Al2O3 tạo ra
b) Sau phản ứng dư chất nào, tính khối lượng chất dư đó?
Cho 5,4 gam Al tác dụng với 25,55 g HCL thu được muối nhôm tạo ra và giai phong khí hidro a)Viết phương trình phản ứng b)chất nào dư sau phản ứng?Tính khối lượng các chất sau phản ứng
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ n_{HCl}=\dfrac{25,55}{36,5}=0,7\left(mol\right)\\a. 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ b.Vì:\dfrac{0,2}{2}< \dfrac{0,7}{6}\\ \Rightarrow HCldư\\ n_{HCl\left(dư\right)}=0,7-\dfrac{6}{2}.0,2=0,1\left(mol\right)\\ n_{AlCl_3}=n_{Al}=0,2\left(mol\right)\\ n_{H_2}=\dfrac{3}{2}.0,2=0,3\left(mol\right)\\ m_{H_2}=0,3.2=0,6\left(g\right)\\ m_{HCl\left(dư\right)}=0,1.36,5=3,65\left(g\right)\\ m_{AlCl_3}=133,5.0,2=26,7\left(g\right)\)
Đúng 3
Bình luận (0)
cho 5,4(g) Al tác dụng với 6,4(g) O2. Tính khối lượng các chất sau phản ứng
nAl = \(\dfrac{5,4}{27}=0,2\) mol
nO2 = \(\dfrac{6,4}{32}=0,2\) mol
Pt: 4Al + 3O2 --to--> 2Al2O3
0,2 mol->0,15 mol-> 0,1 mol
Xét tỉ lệ mol giữa Al và O2:
\(\dfrac{0,2}{4}< \dfrac{0,2}{3}\)
Vậy O2 dư
mAl2O3 = 0,1 . 102 = 10,2 (g)
mO2 dư = (0,2 - 0,15) . 32 = 1,6 (g)
Đúng 0
Bình luận (0)
4Al + 3O2 + 2Al2O3
0,2 0,15 0,1
nAl = m/M=5,4/27=0,2
mAl2O3= n.M=0,1×(27×2+16×3)=10,2g
Đúng 0
Bình luận (0)
nAl = 0,2 mol
nO2 = 0,2 mol
4Al + 3O2 → 2Al2O3
Đặt tỉ lệ ta có
\(\dfrac{0,2}{4}\) < \(\dfrac{0,2}{3}\)
⇒ O2 dư
⇒ mAl2O3 = 0,1.102 = 10,2 (g)
⇒ mO2 dư = ( 0,2-0,15 ).32 = 1,6 (g)
Đúng 0
Bình luận (0)
cho 10,8 g Al tác dụng với 6,048 lít O2 điều kiện tiêu chuẩn
a, Lập phương trình hóa học
b, chất nào còn dư sau phản ứng và dư là bao nhiêu gam
c, Tính khối lượng sản phẩm thu được
\(PTHH:4Al+3O_2->2Al_2O_3\)
BĐ 0,4 0,27 (mol)
PU 0,36---->0,27---->0,18 (mol)
CL 0,04---->0------>0,18 (mol)
b)
\(n_{Al}=\dfrac{m}{M}=\dfrac{10,8}{27}=0,4\left(mol\right)\)
\(n_{O_2}=\dfrac{V}{22,4}=\dfrac{6,048}{22,4}=0,27\left(mol\right)\)
\(\dfrac{n_{Al}}{4}>\dfrac{n_{O_2}}{3}\left(\dfrac{0,4}{4}>\dfrac{0,27}{3}\right)\)
=> Al dư, O2 hết (tính theo O2)
\(m_{Al}=n\cdot M=0,04\cdot27=1,08\left(g\right)\)
c)
\(m_{Al_2O_3}=n\cdot M=0,18\cdot\left(27\cdot2+16\cdot3\right)=18,36\left(g\right)\)
Đúng 2
Bình luận (2)
a, PT: \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
b, Ta có: \(n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\)
\(n_{O_2}=\dfrac{6,048}{22,4}=0,27\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,4}{4}>\dfrac{0,27}{3}\), ta được Al dư.
Theo PT: \(n_{Al\left(pư\right)}=\dfrac{4}{3}n_{O_2}=0,36\left(mol\right)\)
\(\Rightarrow n_{Al\left(dư\right)}=0,4-0,36=0,04\left(mol\right)\)
\(\Rightarrow m_{Al\left(dư\right)}=0,04.27=1,08\left(g\right)\)
c, Theo PT: \(n_{Al_2O_3}=\dfrac{2}{3}n_{Al}=0,18\left(mol\right)\)
\(\Rightarrow m_{Al_2O_3}=0,18.102=18,36\left(g\right)\)
Đúng 2
Bình luận (2)
Cho các chất sau: Ba, BaO, Al, C, SO3, P2O5, H2O, O2, H2, CuO, Na, Na2O Những chất nào tác dụng với nhau, viết phương trình phản ứng xảy ra nếu có.
: Cho các chất sau: Ba, BaO, Al, C, SO3, P2O5, H2O, O2, H2, CuO, Na, Na2O Những chất nào tác dụng với nhau, viết phương trình phản ứng xảy ra nếu có.