Chuẩn bị: Dung dịch CH3COOH 1 M, phoi bào magnesium; ống nghiệm.
Tiến hành: Cho 1 – 2 mL dung dịch acetic acid 1M vào ống nghiệm, sau đó thêm vào vài mẩu magnesium.
Yêu cầu: Quan sát, mô tả hiện tượng xảy ra và giải thích.
Chuẩn bị: Dung dịch CH3COOH 1 M, dung dịch Na2CO3 1M; ống nghiệm, diêm.
Tiến hành: Cho 1 – 2 mL dung dịch sodium carbonate 1 M vào ống nghiệm. Nhỏ tiếp vào ống nghiệm 1 – 2 mL dung dịch acetic acid 1 M. Đưa que diêm đang cháy vào miệng ống nghiệm.
Yêu cầu: Quan sát, mô tả hiện tượng xảy ra và giải thích.
Tham khảo:
- Hiện tượng:
+ Khi cho dung dịch acetic acid vào ống nghiệm chứa dung dịch sodium carbonate thì thấy bọt khí xuất hiện.
+ Khi đưa que diêm đang cháy vào miệng ống nghiệm, que diêm tắt.
- Giải thích: Acetic acid phản ứng với sodium carbonate, sinh ra khí carbon dioxide. Khí carbondioxide không duy trì sự cháy, làm tắt que diêm.
- Phương trình hóa học: 2CH3COOH + Na2CO3 → 2CH3COONa + H2O + CO2↑
tính ph tại điểm tương đương khi chuẩn độ dung dịch ch3cooh. a. 1M và b. 0,1 M bằng dung dịch chuẩn naoh cùng nồng độ
Chuẩn độ CH 3 COOH bằng dung dịch NaOH 0,1M. Kết quả thu được bảng sau đây:
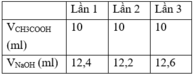
Vậy khối lượng CH 3 COOH có trong 1 lít dung dịch là:
A.7,44
B. 6,6
C. 5,4
D. 6,0
để a g phoi bào sắt ngoài không khí,sau một thời gian bị oxi hóa biến thành hỗn hợp B gồm có Fe,FeO,Fe2O3,Fe3O4 với khối lượng 30g.Hòa tan hoàn toàn dung dịch B bằng dung dịch HNO3 thu đc 5,6l khí NO duy nhất(đktc)
a)Viết pthh các p/ứ xảy ra
b)Tính a?
Cách này ko cần viết phương trình :3
Quy đổi hh gồm Fe (a mol) và O (b mol)
\(\Rightarrow56a+16b=30\) (1)
Ta có: \(n_{NO}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Bảo toàn electron: \(3n_{Fe}=2n_O+3n_{NO}\) \(\Rightarrow3a-2b=0,75\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,45\\b=0,3\end{matrix}\right.\)
Vì mFe trong oxit cũng là mFe ban đầu \(\Rightarrow m_{Fe}=0,45\cdot56=25,2\left(g\right)\)
Chuẩn bị: Dung dịch phenol ở dạng huyền phù, dung dịch NaOH 1M; ống nghiệm.
Tiến hành: Chuẩn bị một ống nghiệm chứa khoảng 1 mL dung dịch phenol dạng huyền phù. Nhỏ từ từ khoảng 2 mL dung dịch sodium hydroxide 1 M vào ống nghiệm. Lắc đều ống nghiệm.
Yêu cầu: Quan sát, mô tả hiện tượng xảy ra và giải thích.
Hiện tượng: dung dịch ở dạng huyền phù có màu trắng đục chuyển dang trong suốt
Giải thích: Phenol tan trong dung dịch sodium hydroxide tạo dung dịch C6H5ONa trong suốt
PTHH: C6H5OH + NaOH → C6H5ONa + H2O
Chuẩn độ 25 ml dung dịch CH3COOH chưa biết nồng độ đã dùng hết 37,5 ml dung dịch NaOH 0,05M. Xác định nồng độ mol của dung dịch CH3COOH.
A. 0,075M
B. 0,15M
C. 0,05M
D. 0,025M
Đáp án A
![]() (1)
(1)
nNaOH= 0,0375.0,05 = 0,001875(mol)
Theo(1): nCH3COOH = nNaOH = 0,001875(mol)
Nồng độ mol của dung dịch CH3COOH là: 0,001875/0,025=0,075(M)
1. Cho 360 g dung dịch CH3COOH a% tham gia phản ứng NaHCO3 thu được 2,688 lít khí CO2 ở điều kiện tiêu chuẩn. Giá trị của a là gì?
2. Trung hòa hoàn toàn 100 ml dung dịch axit axetic nồng độ 0,5 M cần bao nhiêu ml dung dịch Kali hiđroxit 0,2 M?
3. Dẫn 0,92 g hỗn hợp X gồm etilen và metan đi qua bình đựng dung dịch nước brom dư, sau phản ứng thấy có 896 ml khí thoát ra (điều kiện tiêu chuẩn). Phần trăm thể tích của etilen trong X là bao nhiêu?
MÌNH CẦN GẤP TRONG TỐI NAY MONG CÁC BẠN GIÚP NHANH VỚI! THANKS NHIỀU AK!
Help mik với mấy bạn:
Câu 14. Cho 13,5g Al phản ứng với dung dịch H2SO4 theo sơ đồ sau:
Tính thể tích H2 thu được ở điều kiện chuẩn biết hiệu suất phản ứng là 90%
Câu 15. Tính số nguyên tử Magnesium có trong 48 gam Magnesium
Tính thể tích ở điều kiện chuẩn của 0,6022.1023 phân tử oxygen.
Câu 16. Biết rằng tỉ khối của khí Y so với khí NO2 là 0,5 và tỉ khối của khí X so với khí Y là 2,5. Xác định khối lượng mol của khí X.
Chuẩn bị:
● Dụng cụ: Cân điện tử, bình tam giác (loại 100 ml), ống đong.
● Hoá chất: Bột sodium hydrogencarbonate (NaHCO3), dung dịch giấm ăn (CH3COOH).Tiến hành:
Bước 1: Đặt bình tam giác có chứa 10 ml giấm ăn và một mẩu giấy có chứa một thì cafe bột NaHCO3 trên đĩa cân điện tử. Ghi chỉ số khối lượng hiện trên mặt cân (kí hiệu là mA).
Bước 2: Đổ bột NaHCO3 vào bình tam giác, đặt lại mẩu giấy lên đĩa cân, ghi chỉ số khối lượng hiện trên mặt cân (kí hiệu là mB).
● Mô tả hiện tượng thí nghiệm, cho biết khối lượng mA và mB.
● So sánh mA và mB. Giải thích.
- Hiện tượng thí nghiệm: có khí thoát ra. Học sinh làm thí nghiệm và ghi lại giá trị mA, mB.
- So sánh: mA > mB. Giải thích:
Phản ứng hoá học xảy ra ở thí nghiệm 2 có thể được biểu diễn bằng sơ đồ ở dạng chữ như sau:
Acetic acid + Sodium hydrogencarbonate → Sodium acetate + Carbon dioxide + Nước
Vậy mA > mB do sau phản ứng có khí carbon dioxide thoát ra khỏi bình.