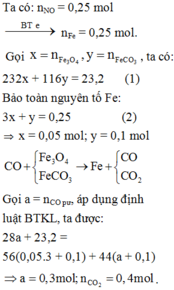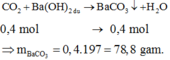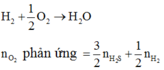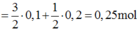Câu 12: Đem nung hoàn toàn 29,2 gam hỗn hợp gồm Al(OH)3; và Fe(OH)3; thu được hỗn hợp chất rắn có khối lượng 21,1 gam. a. Viết phương trình hóa học xảy ra. b. Tính khối lượng mỗi bazơ hỗn bazơ trong hỗn hợp ban đầu.

Những câu hỏi liên quan
Câu 12: Đem nung hoàn toàn 29,2 gam hỗn hợp gồm Al(OH)3; và Fe(OH)3; thu được hỗn
hợp chất rắn có khối lượng 21,1 gam.
a. Viết phương trình hóa học xảy ra.
b. Tính khối lượng mỗi bazơ hỗn bazơ trong hỗn hợp ban đầu.
Hoà tan hoàn toàn 10,45 gam hỗn hợp gồm Fe, Al, Mg vào dung dịch HCl. Dung dịch thu được sau phản ứng đem trộn với dung dịch NaOH dư được 14,05 gam kết tủa và dung dịch A. Nung kết tủa trong không khí thấy tạo thành 12 gam hỗn hợp gồm hai oxit kim loại. Cho khí CO2 lội qua dung dịch A thu được 11,7 gam kết tủa trắng dạng keo. Viết phương trình phản ứng và tính hiệu suất của phản ứng nung kết tủa.
Đọc tiếp
Hoà tan hoàn toàn 10,45 gam hỗn hợp gồm Fe, Al, Mg vào dung dịch HCl. Dung dịch thu được sau phản ứng đem trộn với dung dịch NaOH dư được 14,05 gam kết tủa và dung dịch A. Nung kết tủa trong không khí thấy tạo thành 12 gam hỗn hợp gồm hai oxit kim loại. Cho khí CO2 lội qua dung dịch A thu được 11,7 gam kết tủa trắng dạng keo. Viết phương trình phản ứng và tính hiệu suất của phản ứng nung kết tủa.
Hòa tan hoàn toàn hỗn hợp gồm 7,8 gam Al và Mg cần dùng 29,2 gam HCl , tính khối lượng mỗi kim loại ban đầu
Gọi số mol Al, Mg là a, b (mol)
=> 27a + 24b = 7,8 (1)
\(n_{HCl}=\dfrac{29,2}{36,5}=0,8\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a---->3a
Mg + 2HCl --> MgCl2 + H2
b-->2b
=> 3a + 2b = 0,8 (2)
(1)(2) => a = 0,2 (mol); b = 0,1 (mol)
\(\left\{{}\begin{matrix}m_{Al}=0,2.27=5,4\left(g\right)\\m_{Mg}=0,1.24=2,4\left(g\right)\end{matrix}\right.\)
Đúng 4
Bình luận (0)
Trong bài tập trắc nghiệm Câu 12: Nung nóng 26,2 gam hỗn hợp kim loại gồm: Mg, Al, Zn trong không khí đến khi phản ứng xảy ra hoàn toàn thu được 40,6 gam hỗn hợp 3 oxit. Để hoàn tan hết lượng oxit trên cần V lít dung dịch HCl 0,5M. Giá trị V là1,8 lít. 2,24 lít. 3,36 lít. 0,896 lít.- Khối lượng n.tử O 40,6-26,2 14,4g-- mol O 14,4: 16 0,9mol n.tử-- số mol HCl 2 số mol O 1,8 mol-- Vd.d HCl 3,6 lít! Sao mình tính ra là 3,6 lít nhỉ?
Đọc tiếp
Trong bài tập trắc nghiệm Câu 12: Nung nóng 26,2 gam hỗn hợp kim loại gồm: Mg, Al, Zn trong không khí đến khi phản ứng xảy ra hoàn toàn thu được 40,6 gam hỗn hợp 3 oxit. Để hoàn tan hết lượng oxit trên cần V lít dung dịch HCl 0,5M. Giá trị V là
1,8 lít. 2,24 lít. 3,36 lít. 0,896 lít.- Khối lượng n.tử O = 40,6-26,2= 14,4g--> mol O = 14,4: 16 = 0,9mol n.tử--> số mol HCl = 2 số mol O = 1,8 mol--> Vd.d HCl = 3,6 lít! Sao mình tính ra là 3,6 lít nhỉ?
Nung nóng hoàn toàn 16,5 gam hỗn hợp X gồm Fe(OH)3 và Mg(OH)2, sau phản ứng thu được 12 gam chất rắn.
a)Tính thành phần % về khối lượng mỗi chất trong hỗn hợp X.
b) Hòa tan toàn bộ hỗn hợp X trên vào 200 gam dung dịch H2SO4. Tính nồng độ phần trăm của mỗi muối trong dung dịch thu được.
2Fe(OH)3 -----to---> Fe2O3 + 3H2O
Mg(OH)2 ----to---> MgO + H2O
Gọi x, y lần lượt là số mol Fe(OH)3 và Mg(OH)2
\(\left\{{}\begin{matrix}107x+58y=16,5\\\dfrac{1}{2}.160x+y.40=12\end{matrix}\right.\)
=> x=0,1 ; y=0,1
\(\%m_{Fe\left(OH\right)_3}=\dfrac{107.0,1}{16,5}.100=64,85\%\)
%Mg(OH)2 = 35,15%
b) \(2Fe\left(OH\right)_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+6H_2O\)
0,1----------------------------------->0,05
\(Mg\left(OH\right)_2+H_2SO_4\rightarrow MgSO_4+2H_2O\)
0,1------------------------------------>0,1
\(m_{ddsaupu}=16,5+200=216,5\left(g\right)\)
\(C\%_{Fe_2\left(SO_4\right)_3}=\dfrac{0,05.400}{216,5}.100=9,24\%\)
\(C\%_{MgSO_4}=\dfrac{0,1.12}{216,5}.100=5,54\%\)
Đúng 0
Bình luận (0)
Cho 7,65 gam hỗn hợp Al và Mg tan hoàn toàn trong 500 ml dung dịch gồm HCl 1,04M và
H
2
S
O
4
0,28M, thu được dung dịch X và khí
H
2
. Cho 850 ml dung dịch NaOH 1M vào X, sau phản ứng hoàn toàn thu được 16,5 gam kết tủa gồm hai chất. Mặt khác, cho từ từ dung dịch hỗn hợp KOH 0,8M và
B
a
(
O
H
)
2...
Đọc tiếp
Cho 7,65 gam hỗn hợp Al và Mg tan hoàn toàn trong 500 ml dung dịch gồm HCl 1,04M và H 2 S O 4 0,28M, thu được dung dịch X và khí H 2 . Cho 850 ml dung dịch NaOH 1M vào X, sau phản ứng hoàn toàn thu được 16,5 gam kết tủa gồm hai chất. Mặt khác, cho từ từ dung dịch hỗn hợp KOH 0,8M và B a ( O H ) 2 0,1M vào X đến khi lượng kết tủa lớn nhất, lọc kết tủa đem nung đến khối lượng không đổi, thu được m gam chất rắn. Giá trị của m gần nhất với giá trị nào sau đây
A. 38,6
B. 27,4
C. 32,3
D. 46,3
Đáp án A
Khi thêm 0,85 mol NaOH vào X thì thu được dung dịch chứa NaCl: 0,52 mol và Na2SO4 : 0,14mol;
Vì n N a O H > n N a C l + 2 n N a 2 S O 4 nên còn N a A l O 2
Bảo toàn Na có n N a O H = n N a C l + 2 n N a 2 S O 4 + n N a A l O 2 → 0 , 85 = 0 , 52 + 2 . 0 , 14 + n N a A l O 2
→ n N a A l O 2 = 0,05 mol
Kết tủa thu được là M g ( O H ) 2 : x mol và A l ( O H ) 3 : y mol
Ta có hệ sau
→ dd X có A l + 3 : 0 , 15 m o l ; M g + 2 : 0 , 15 m o l ; C l - : 0 , 52 m o l ; S O 4 2 - : 0 , 14 m o l
Ta thấy X có 3 n A l + 2 n M g < n C l + 2 n S O 4 nên X có dư H + → n H + = 0,52 + 0,14.2 -0,15.3 -0,15.2 = 0,05 mol
OH- + H + → H2O
OH- + M g + 2 → M g ( O H ) 2
3OH- + A l + 3 → A l ( O H ) 3
B a 2 + + S O 4 2 - → B a S O 4
A l ( O H ) 3 + O H - → A l O 2 - + 2 H 2 O
Khi thêm 8x mol KOH và x mol B a ( O H ) 2 vào dung dịch X thì để thu được lượng kết tủa lớn nhất ta xét các TH sau
TH1 : kết tủa có B a S O 4 : 0,14 mol và M g ( O H ) 2 : 0,15 mol và có thể có A l ( O H ) 3
Bảo toàn Ba có x = 0,14 mol → n O H =8x + 2x =10x =1,4 mol > 2 n M g + 4 n A l + n H + = 0,95
→ phản ứng có kết tủa A l ( O H ) 3 bị hòa tan hết → kết tủa thu được là B a S O 4 và M g ( O H ) 2
→ đem nung thu được B a S O 4 : 0,14 mol và MgO : 0,15 mol → m = 38,62g
TH2: Kết tủa có A l ( O H ) 3 : 0,15 mol và Mg(OH)2: 0,15 mol; B a S O 4
Ta có n O H = 10x = 0,15.3 + 0,15.2 +0,05=0,8 → x = 0,08 mol→ có 0,08 mol B a S O 4
→ Đem nhiệt phân thu được 0,08 mol B a S O 4 ; 0,075 mol Al2O3 và 0,15mol MgO
→ m = 0,08.233 + 0,075.102 +0,15.40 =32,29g
Nên TH1 khối lượng kết tủa lớn nhất là 38,62 g gần nhất với 38,6 nhất
Đúng 0
Bình luận (0)
Dẫn khí CO dư đi qua 23,2 gam hỗn hợp X gồm Fe3O4 và FeCO3 nung nóng đến phản ứng hoàn toàn thu được Fe và hỗn hợp khí gồm CO2 và CO. Cho hỗn hợp khí này vào dung dịch Ba(OH)2 dư thấy có m gam kết tủa. Đem hoà tan hoàn toàn lượng Fe thu được trong 400ml dung dịch HNO3 loãng, nóng dư thấy thoát ra 5,6 lít khí NO duy nhất (đktc). Giá trị m là: A. 59,1 gam. B. 68,95 gam. C. 88,65 gam. D. 78,8 gam.
Đọc tiếp
Dẫn khí CO dư đi qua 23,2 gam hỗn hợp X gồm Fe3O4 và FeCO3 nung nóng đến phản ứng hoàn toàn thu được Fe và hỗn hợp khí gồm CO2 và CO. Cho hỗn hợp khí này vào dung dịch Ba(OH)2 dư thấy có m gam kết tủa. Đem hoà tan hoàn toàn lượng Fe thu được trong 400ml dung dịch HNO3 loãng, nóng dư thấy thoát ra 5,6 lít khí NO duy nhất (đktc). Giá trị m là:
A. 59,1 gam.
B. 68,95 gam.
C. 88,65 gam.
D. 78,8 gam.
Có 40,1 gam hỗn hợp X gồm Al và Fe2O3 .Đem nung nóng ,X để thực hiện phản ứng hoàn toàn sau 1 thời gian thu được m gam hỗn hợp rắn Y .Chia Y thành 2 phần bằng nhau :
-P1: hòa tan trong dung dịch NaOH dư thấy thoát ra khí H2
-P2:Hòa tan trong dung dịch HCl dư thấy thoát ra 4,48 lít khí H2
Phần trăm khối lượng của Al trong hỗn hợp X ?
Gọi số mol Al, Fe2O3 mỗi phần lần lượt là a,b (mol) (a,b>0)
- Xét phần 2:
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\\ n_{H_2\left(P2\right)}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ n_{Al\left(P2\right)}=\dfrac{2}{3}.0,2=\dfrac{2}{15}\left(mol\right)\\ m_{Al\left(P2\right)}=\dfrac{2}{15}.27=1,8\left(g\right)\\ m_{P2}=\dfrac{40,1}{2}=20,05\left(g\right)\\ \%m_{\dfrac{Al\left(P2\right)}{P_2}}=\%m_{\dfrac{Al}{2Phần}}=\dfrac{1,8}{20,05}.100\approx8,978\%\)
Đúng 3
Bình luận (0)
P1: Do chất rắn tác dụng với NaOH có khí thoát ra
=> trong Y chứa Al
P2: Gọi (nAl; nFe; nAl2O3) = (a;b;c)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a---------------------->1,5a
Fe + 2HCl --> FeCl2 + H2
b---------------------->b
=> 1,5a + b = \(\dfrac{4,48}{22,4}=0,2\left(mol\right)\) (1)
mY = mX = 40,1
=> 54a + 112b + 204c = 40,1 (2)
PTHH: 2Al + Fe2O3 --to--> Al2O3 + 2Fe
=> \(\dfrac{n_{Fe}}{n_{Al_2O_3}}=\dfrac{2}{1}\) => \(\dfrac{b}{c}=\dfrac{2}{1}\) (3)
(1)(2)(3) => \(\left\{{}\begin{matrix}a=\dfrac{9}{890}\left(mol\right)\\b=\dfrac{329}{1780}\left(mol\right)\\c=\dfrac{329}{3560}\left(mol\right)\end{matrix}\right.\)
=> nAl = 2.(a + 2c) = \(\dfrac{347}{890}\left(mol\right)\)
=> \(\%Al=\dfrac{27.\dfrac{347}{890}}{40,1}.100\%=26,252\%\)
Đúng 0
Bình luận (1)
694169416161616
ngu j m an cuc cho hay j non vcl solo lq ko may
Đúng 0
Bình luận (0)
Nung nóng 5,4 gam Al với 3,2 gam S trong môi trường không có không khí, phản ứng hoàn toàn thu được hỗn hợp rắn X. Cho hỗn hợp X tác dụng với dung dịch H2SO4 loãng dư thu được hỗn hợp khí Y. Đem đốt hoàn toàn hỗn hợp Y cần vừa đủ V lít O2 (đktc). V có giá trị là A. 11,2 lít B. 5,6 lít C. 13,44 lít D. 2,8 lít
Đọc tiếp
Nung nóng 5,4 gam Al với 3,2 gam S trong môi trường không có không khí, phản ứng hoàn toàn thu được hỗn hợp rắn X. Cho hỗn hợp X tác dụng với dung dịch H2SO4 loãng dư thu được hỗn hợp khí Y. Đem đốt hoàn toàn hỗn hợp Y cần vừa đủ V lít O2 (đktc). V có giá trị là
A. 11,2 lít
B. 5,6 lít
C. 13,44 lít
D. 2,8 lít