Viết sơ đồ phản ứng gây ra mưa chứa nitric acid và sulfuric acid.

Những câu hỏi liên quan
Viết phương trình hoá học minh hoạ tác động của mưa acid đối với calcium carbonate trong núi đá vôi và với kim loại sắt có trong thép.
Trong mưa acid chứa sulfuric acid (H2SO4) và nitric acid (HNO3).
Các phương trình hoá học minh hoạ:
- Tác động của mưa acid đối với calcium carbonate trong núi đá vôi:
2H+ + CaCO3 → Ca2+ + CO2 + H2O.
- Tác động của mưa acid đối với kim loại sắt có trong thép:
2H+ + Fe → Fe2+ + H2.
Đúng 1
Bình luận (0)
2,4,6-trinitrotoluene dùng để sản xuất thuốc nổ TNT.
a) Viết phương trình hoá học của phản ứng điều chế 2,4,6-trinitrotoluene từ toluene và nitric acid (xúc tác sulfuric acid).
b) Từ 1 tấn toluene điều chế được bao nhiêu kg 2,4,6-trinitrotoluene, biết hiệu suất của phản ứng là 62%.
Tham khảo:
a) 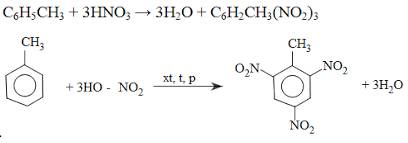
b) PTHH :
C6H5CH3 + 3HNO3 → C6H2(NO2)3CH3 + 3H2O
gam 92 227
kg 1000.62% x
Từ 1 tấn toluene có thể điều chế được số kilôgam 2,4,6-trinitrotoluene, biết hiệu suất của phản ứng là 62% là:
x = 1000*0,62.227 : 92 = 1530 kg
Đúng 1
Bình luận (0)
Viết sơ đồ tạo thành ion H+ từ nitric acid (HNO3).
- Sơ đồ tạo thành ion H+ từ nitric acid (HNO3):
\(HNO_3+H^++NO_3^-\)
Đúng 1
Bình luận (1)
Hòa tan hoàn toàn 15g Calcium sulfite vào dung dịch sulfuric acid 1M vừa đủ phản ứng thu được khí A (đktc) và dung dịch B. ( Biết phản ứng xảy ra hoàn toàn)
a. Tính thể tích dung dịch sulfuric acid cần dùng.
b. Tính nồng độ mol của chất có trong dung dịch B ( biết thể tích dung dịch thay đổi không
a)\(CaSO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\)
tl 1..................2............1.............1..........1(mol)
br0,125........0,25......0,125........0,125....0,125(mol)
\(m_{CaSO_3}=\dfrac{15}{120}=0,125\left(mol\right)\)
\(\Rightarrow VddHCl=\dfrac{n}{C_M}=\dfrac{0,25}{1}=0,25\left(l\right)\)
\(\Rightarrow C_{MCaCl_2}=\dfrac{0,125}{0,25}=0,5\left(M\right)\)
Đúng 8
Bình luận (0)
Bài 2: Hòa tan hoàn toàn 11.2g Iron vào dung dịch sulfuric acid 1M vừa đủ phản ứng thu được khí A (đktc) và dung dịch B. ( Biết phản ứng xảy ra hoàn toàn)a. Tính thể tích dung dịch sulfuric acid cần dùng.b. Tính thể tích khí Ac. Tính nồng độ mol của chất có trong dung dịch BBài 3: Bằng phương pháp hóa học nhận biết 2 dung dịch không màu sau: HCl; H2SO4
Đọc tiếp
Bài 2: Hòa tan hoàn toàn 11.2g Iron vào dung dịch sulfuric acid 1M vừa đủ phản ứng thu được khí A (đktc) và dung dịch B. ( Biết phản ứng xảy ra hoàn toàn)
a. Tính thể tích dung dịch sulfuric acid cần dùng.
b. Tính thể tích khí A
c. Tính nồng độ mol của chất có trong dung dịch B
Bài 3: Bằng phương pháp hóa học nhận biết 2 dung dịch không màu sau: HCl; H2SO4
Bài 3 : Trích mẫu thử :
Cho dung dịch BaCl2 vào 2 mẫu thử :
+ Chất nào xuất hiện kết tủa trắng không tan trong axit : H2SO4
Pt : \(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
Không hiện tượng : HCl
Chúc bạn học tốt
Đúng 2
Bình luận (0)
Bài 2 :
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Pt : \(Fe+H_2SO_4\rightarrow FeSO_4+H_2|\)
1 1 1 1
0,2 0,2 0,2 0,2
a) \(n_{H2SO4}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
\(V_{ddH2SO4}=\dfrac{0,2}{1}=0,2\left(l\right)\)
b) \(n_{H2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,2.22,4=4,48\left(l\right)\)
c) \(n_{FeSO4}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
'\(C_{M_{FeSO4}}=\dfrac{0,2}{0,2}=1\left(M\right)\)
Chúc bạn học tốt
Đúng 1
Bình luận (0)
CÂU 1 Hòa tan hoàn toàn 10,6g sodium carbonate vào dung dịch sulfuric acid 1M vừa đủ phản ứng thu được khí A (đktc) và dung dịch B. ( Biết phản ứng xảy ra hoàn toàn)a. Tính thể tích dung dịch sulfuric acid cần dùng.b. Tính thể tích khí Ac. Tính nồng độ mol của chất có trong dung dịch B
Đọc tiếp
CÂU 1 Hòa tan hoàn toàn 10,6g sodium carbonate vào dung dịch sulfuric acid 1M vừa đủ phản ứng thu được khí A (đktc) và dung dịch B. ( Biết phản ứng xảy ra hoàn toàn)
a. Tính thể tích dung dịch sulfuric acid cần dùng.
b. Tính thể tích khí A
c. Tính nồng độ mol của chất có trong dung dịch B
Câu 1 :
\(n_{Na2CO3}=\dfrac{10,6}{106}=0,1\left(mol\right)\)
Pt : \(Na_2CO_3+H_2SO_4\rightarrow Na_2SO_4+CO_2+H_2O|\)
1 1 1 1 1
0,1 0,1 0,1 0,1
a) \(n_{H2SO4}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
\(V_{ddH2SO4}=\dfrac{0,1}{1}=0,1\left(l\right)\)
b) \(n_{CO2}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
\(V_{CO2\left(dktc\right)}=0,1.22,4=2,24\left(l\right)\)
c) \(n_{Na2SO4}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
\(C_{M_{Na2SO4}}=\dfrac{0,1}{0,1}=1\left(M\right)\)
Chúc bạn học tốt
Đúng 3
Bình luận (0)
Câu 4. Cho một lượng 5,6g Iron – sắt tác dụng với dung dịch Acid Sulfuric (H2SO4) sau phản ứng thuđược 0,1g khí hydrogen (H2) và 15,2g muối sắt (FeSO4).a. Viết phương trình chữ và phương trình hóa họcb. Tính khối lượng Acid sulfuric cần dùng cho phản ứng.Câu 5. Cho 0,2g khí hydrogen tác dụng với 16g Iron (III) oxide (Fe2O3), sau phản ứng thu được chất X và1,8g nướca. Tính khối lượng chất Xb. Xác định công thức của chất X, biết X là hợp chất gồm 2 nguyên tố Fe và O, biết phân tử khối củaX 80dvC....
Đọc tiếp
Câu 4. Cho một lượng 5,6g Iron – sắt tác dụng với dung dịch Acid Sulfuric (H2SO4) sau phản ứng thu
được 0,1g khí hydrogen (H2) và 15,2g muối sắt (FeSO4).
a. Viết phương trình chữ và phương trình hóa học
b. Tính khối lượng Acid sulfuric cần dùng cho phản ứng.
Câu 5. Cho 0,2g khí hydrogen tác dụng với 16g Iron (III) oxide (Fe2O3), sau phản ứng thu được chất X và
1,8g nước
a. Tính khối lượng chất X
b. Xác định công thức của chất X, biết X là hợp chất gồm 2 nguyên tố Fe và O, biết phân tử khối của
X < 80dvC.
Cho 14,4 gam magnesium vào dung dịch sulfuric acid loãng thu được magnesium sulfate và hydrogen (đkc)
a) viết PTHH
b) tính khối lượng acid đã tham gia phản ứng
c) tính thể tích không khí (đkc) cần để đốt cháy hết lượng hydrogen sinh ra ở phản ứng trên
(Mg=24, S=32, O=16, H=1)
a) Mg + H2SO4 --> MgSO4 + H2
b) \(n_{Mg}=\dfrac{14,4}{24}=0,6\left(mol\right)\)
PTHH: Mg + H2SO4 --> MgSO4 + H2
0,6--->0,6------->0,6----->0,6
=> \(m_{H_2SO_4}=0,6.98=58,8\left(g\right)\)
c)
PTHH: 2H2 + O2 --to--> 2H2O
0,6-->0,3
=> VO2 = 0,3.24,79 = 7,437 (l)
=> Vkk = 7,437.5 = 37,185 (l)
Đúng 2
Bình luận (3)
Cho 5,4 gam Aluminium ( nhôm )phản ứng hết với 300ml dung dich Sulfuric acid (H2SO4) a,/ Tính nồng độ mol dung dịch Sulfuric acid b./ Tính khối lượng muối sinh ra c./ Tính thể tích khí sinh ra ở đkc
Đọc tiếp
Cho 5,4 gam Aluminium ( nhôm )phản ứng hết với
300ml dung dich Sulfuric acid (H2SO4)
a,/ Tính nồng độ mol dung dịch Sulfuric acid
b./ Tính khối lượng muối sinh ra
c./ Tính thể tích khí sinh ra ở đkc
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ 0,2........0,3...........0,1...........0,3\left(mol\right)\\ a.C_{MddH_2SO_4}=\dfrac{0,3}{0,3}=1\left(M\right)\\ b.m_{Al_2\left(SO_4\right)_3}=342.0,1=34,2\left(g\right)\\ c.V_{H_2\left(đktc\right)}=0,3.22,4=6,72\left(l\right)\)
Đúng 2
Bình luận (0)
PTHH: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
a) \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{3}{2}n_{Al}=0,3\left(mol\right)\)
\(\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,3}{0,3}=1M\)
b) \(n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Al}=0,1\left(mol\right)\)
\(\Rightarrow m_{Al_2\left(SO_4\right)_3}=n.M=0,1.342=34,2\left(g\right)\)
c) \(n_{H_2}=n_{H_2SO_4}=0,3\left(mol\right)\)
\(\Rightarrow V_{H_2}=n.22,4=0,3.22,4=6,72\left(l\right)\)
Đúng 1
Bình luận (0)
























