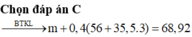Hòa tan m gam Fe3O4 cần dùng 400 mL dung dịch H2SO4 loãng 0,025M. Viết PTPU và tính V?

Những câu hỏi liên quan
Hòa tan hết 8 gam Fe2O3 cần dùng m gam dung dịch H2SO4 4,9%. Hãy viết PTPU xảy ra và tính m ?
\(n_{Fe_2O_3}=\dfrac{8}{160}=0,05\left(mol\right)\\ PTHH:Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\\ n_{H_2SO_4}=3.0,05=0,15\left(mol\right)\\ m=m_{ddH_2SO_4}=\dfrac{0,15.98.100}{4,9}=300\left(g\right)\)
Đúng 2
Bình luận (0)
Cho m gam Fe tan hết trong 400 ml dung dịch FeCl3 1M thu được dung dịch Y. Cô cạn Y thu được 68,92 gam chất rắn khan. Để hòa tan hết m gam Fe trên cần tối thiểu bao nhiêu ml dung dịch hỗn hợp H2SO4 0,2M và Fe(NO3)3 0,025M (sản phẩm khử N+5 là NO duy nhất)? A.800 ml B. 560 ml C. 400 ml D. 200 ml
Đọc tiếp
Cho m gam Fe tan hết trong 400 ml dung dịch FeCl3 1M thu được dung dịch Y. Cô cạn Y thu được 68,92 gam chất rắn khan. Để hòa tan hết m gam Fe trên cần tối thiểu bao nhiêu ml dung dịch hỗn hợp H2SO4 0,2M và Fe(NO3)3 0,025M (sản phẩm khử N+5 là NO duy nhất)?
A.800 ml
B. 560 ml
C. 400 ml
D. 200 ml
Hòa tan hoàn toàn m gam Mg cần dùng V lít dung dịch HCl 0,4M thu được dung dịch X và 2,479 lít H2 (đkc). Viết PTPU xảy ra? Tính m và V?
\(Mg+2HCl\rightarrow MgCl_2+H_2\\ n_{Mg}=n_{H_2}=\dfrac{2,479}{24,79}=0,1\left(mol\right);n_{HCl}=2.0,1=0,2\left(mol\right)\\ m=m_{Mg}=0,1.24=2,4\left(g\right);V=V_{ddHCl}=\dfrac{0,2}{0,4}=0,5\left(l\right)\)
Đúng 2
Bình luận (0)
Cho hỗn hợp gầm m gam bột Cu và 27,84 gam
F
e
3
O
4
vào dung dịch
H
2
S
O
4
loãng dư thấy tan hoàn toàn thu được dung dịch X. Để oxit hóa hết
F
e
2
+
trong dung dịch X cần dùng 90 ml dung dịch
K
M
n
O...
Đọc tiếp
Cho hỗn hợp gầm m gam bột Cu và 27,84 gam F e 3 O 4 vào dung dịch H 2 S O 4 loãng dư thấy tan hoàn toàn thu được dung dịch X. Để oxit hóa hết F e 2 + trong dung dịch X cần dùng 90 ml dung dịch K M n O 4 0,5M. Giá trị của m là
A. 3,36
B. 5,12
C. 2,56
D. 3,20
Cho 10,8 (g) hỗn hợp A gồm Fe và Fe2O3 tác dụng với dung dịch H2SO4 loãng, dư thu được 1,12 lít khí (đktc).
a) Viết PTPU xảy ra
b) Tính khối lượng mỗi chất trong hỗn hợp A
c) Phải dùng bao nhiêu ml dung dịch H2SO4 1M để hòa tan 10,8g hỗn hợp A ở trên?
d) Nếu cho hỗn hợp A ở trên vào dd H2SO4 đặc,nóng thì khối lượng muối sunfat thu được sau phản ứng là bao nhiêu?
Hòa tan hoàn toàn 5,4 gam kim loại nhôm cần dùng 100 ml dung dịch H2SO4 loãng
a, Tính thể tích khí thoát ra ở điều kiện tiêu chuẩn
b, Tính nồng độ mol của dung dịch (H2SO4) đã dùng
Xem chi tiết
nAl = 5.4/27 = 0.2 (mol)
2Al + 3H2SO4 => Al2(SO4)3 + 3H2
0.2____0.3_________________0.3
VH2 = 0.3*22.4 = 6.72(l)
CM H2SO4 = 0.3/0.1 = 3 M
Đúng 2
Bình luận (0)
PTHH: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
\(\Rightarrow n_{H_2}=0,3mol=n_{H_2SO_4}\) \(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=0,3\cdot22,4=6,72\left(l\right)\\C_{M_{H_2SO_4}}=\dfrac{0,3}{0,1}=3\left(M\right)\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Hỗn hợp A gồm FeO, Fe2O3, Fe3O4 (trong đó số mol FeO bằng số mol Fe2O3). Hòa tan 4,64 gam A trong dung dịch H2SO4 loãng dư được 200 ml dung dịch X. Tính thể tích dung dịch KMnO4 0,1M cần thiết để chuẩn độ hết 100 ml dung dịch X? A. 0,1l B. 0,12l C. 0,2l D.0,24l
Đọc tiếp
Hỗn hợp A gồm FeO, Fe2O3, Fe3O4 (trong đó số mol FeO bằng số mol Fe2O3). Hòa tan 4,64 gam A trong dung dịch H2SO4 loãng dư được 200 ml dung dịch X. Tính thể tích dung dịch KMnO4 0,1M cần thiết để chuẩn độ hết 100 ml dung dịch X?
A. 0,1l
B. 0,12l
C. 0,2l
D.0,24l
Đáp án C
Vì số mol của FeO bằng số mol của Fe2O3 nên ta coi hỗn hợp là Fe3O4
Ta có:
Fe3O4 +4H2SO4 → FeSO4 +Fe2(SO4)3 +4H2O
0,02 0,02
Trong 100 ml X sẽ có 0,01 mol FeSO4 nên:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
→ nKMnO4 = 0,02 mol → VKMnO4 = 0,02/0,1 = 0,2 l
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 12,8g hh A gồm Fe và FeO trong 250 ml dd H2SO4 1M loãng (lấy dư) thu được 2,24l H2 (đktc) và dung dịch B.
a. Tính phần trăm khối lượng mỗi chất trong hh A .
b, Trung hòa dung dịch B cần dùng V ml dung dịch NaOH 1M. Tính giá trị V
a, gọi a= nFe
b= nFeO
=> 56a + 72b= 12,8 (1)
Fe +H2SO4 -> FeSO4 +H2
a b b a
FeO +H2SO4 -> FeSO4 +H2O
b b b
a=nH2 = 2,24/22,4= 0,1 mol
từ (1) => b= 0,1
mFe= 56.0,1=5,6(g)
m FeO = 72.0,1= 7,2(g)
b, nH2SO4 (bđ) = 0,25 mol
nH2SO4 pứ = a+b =0,2 mol
=> nH2SO4 dư = 0,25-0,2=0,05 mol
2NaOH +H2SO4 -> Na2SO4 +2H2O
0,1 0,05
V(NaOH)= 0,1/ 1= 0,1 lit =100ml
Đúng 1
Bình luận (1)
E tham khảo! Anh nãy làm tại câu hỏi bấm lộn xóa

Đúng 2
Bình luận (0)
Hòa tan hoàn toàn m gam Al cần dùng 600ml dung dịch h2so4 0,5M(loãng) thu đc dung dịch Y (chứa m gam muối)và 4,48lits h2(đktc).tính khối lượng mỗi kim loại trong x và tính m