Cách nhận biết các kim loại trắng P2O5 , BaO , Ba , Mg , Ag

Những câu hỏi liên quan
Cho các kim loại: Ba, Mg, Al, Fe, Ag. Chỉ dùng dung dịch H 2 S O 4 loãng sẽ nhận biết được bao nhiêu kim loại?
A. 5
B. 2
C. 4
D. 3
Có 5 kim loại là Mg, Ba, AI, Fe, Ag. Nếu chỉ dùng thêm dung dịch H2SO4 loãng thì có thể nhận biết được các kim loại
A. Mg, Ba, Ag.
B. Mg, Ba, AI.
C. Mg, Ba, Al, Fe.
D. Mg, Ba, AI, Fe, Ag.
Trích mẩu thử cho mỗi lần thí nghiệm. Cho dung dịch H2SO4 loãng lần lượt vào các mẩu thử.
- Kim loại không tan là Ag, các kim loại còn lại tan và tạo khí H2 và các dung dịch muối.
- Trường hợp tạo kết tủa là Ba. Lọc bỏ kết tủa rồi lấy dung dịch nước lọc có chứa Ba(OH)2 cho tác dụng với các dung dịch muối ở trên.
+ Dung dịch tạo kết tủa trắng xanh rồi hóa nâu là FeSO4.
=> kim loại ban đầu là Fe.
+ Dung dịch tạo kết tủa keo trắng rồi tan dần là Al2(SO4)3 => kim loại
ban đầu là Al.
+ Dung dịch tạo kết tủa trắng là MgSO4 => kim loại ban đầu là Mg.
Đúng 0
Bình luận (0)
Bài 1: Hoàn thành chuỗi phản ứng sau:
Ca -> CaO -> Ca(OH)2 -> CaCO3 -> H2O -> H2SO4
Bài 2: Nhận biết các chất rắn trắng P2O5, BaO, Ba, Mg, Ag
Bài 3: Hoà tan hoàn toàn 10,96g kim loại R (hoá trị 2) trong H2O dư, sau phản ứng thu được 1,792 lít H2(đktc). Xác định kim loại đã dùng.
:))) hì hì giúp tớ với, tớ cảm ơnnn
Bài 1.
\(2Ca+O_2\rightarrow\left(t^o\right)2CaO\)
\(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
\(Ca\left(OH\right)_2+CO_2\leftarrow CaCO_3\downarrow+H_2O\)
\(CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\)
\(SO_3+H_2O\rightarrow H_2SO_4\)
Bài 2.
Lấy mẫu thử, đánh stt
- Cho các mẫu thử vào nước
+) Tan, sủi bọt khí: Ba
+) Tan: P2O5, BaO (1)
+) Không tan: Mg, Ag (2)
- Cho quỳ tím vào dd của (1):
+) Quỳ hóa xanh: BaO
+) Quỳ hóa đỏ: P2O5
- Cho dung dịch H2SO4 vào (2):
+) Tan, sủi bọt khí: Mg
+) Không tan: Ag
PTHH:
\(Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\)
\(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
\(BaO+H_2O\rightarrow Ba\left(OH\right)_2\)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
Bài 3.
Gọi hóa trị của R là n
\(n_{H_2}=\dfrac{1,792}{22,4}=0,08\left(mol\right)\)
\(2R+2nH_2O\rightarrow2R\left(OH\right)_n+nH_2\)
\(\dfrac{0,16}{n}\) 0,08 ( mol )
\(M_R=\dfrac{10,96}{\dfrac{0,16}{n}}=68,5n\)
`@n=1->` Loại
`@n=2->R=137` `->` R là Bari ( Ba )
`@n=3->` Loại
Vậy R là Bari ( Ba )
Đúng 3
Bình luận (2)
ẫn luồng khí CO đi qua ống sứ chứa 0,3 mol hỗn hợp A(FeO và Fe2O3) nung nóng . Sau một thời gian pư thu được 24g chất rắn B gồm FeO,Fe3O4,Fe2O3,Fe và 11,2 lít hỗn hợp khí X(đktc).Tỉ khối hơi của X so với H2 là 20,4.Tính % khối lượng các chất trong A.
Đúng 0
Bình luận (0)
Có 5 mẫu kim loại là Mg, Al, Ba, Fe, Ag. Nếu chỉ dùng thêm dung dịch H2SO4 thì có thể nhận biết được những mẫu kim loại nào ?
A. Mg, Ba, Ag.
B. Mg, Ba, Al.
C. Mg, Ba, Al, Fe.
D. Cả 5 mẫu kim loại.
Đáp án D.
- Cho dd H2SO4 loãng lần vào các mẫu thử:
+ Mẫu có khí thoát ra có có kết tủa trắng là Ba
Ba + H2SO4 → BaSO4↓ + H2↑
+ Mẫu có khí thoát ra và dung dịch muối thu được có màu trắng xanh là Fe
Fe + H2SO4 → FeSO4 + H2↑
+ Mẫu không tan là Ag
+ 2 mẫu còn lại cùng có khí không màu thoát ra là Al và Mg
Mg + H2SO4 → MgSO4 + H2↑
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
- Lấy một lượng dư kim loại Ba (đã nhận biết được ở trên) nhỏ vài giọt dd H2SO4 loãng đến sẽ xảy ra phản ứng
Ba + H2SO4 → BaSO4↓ + H2↑
Ba + 2H2O → Ba(OH)2 + H2↑
Lọc bỏ kết tủa BaSO4↓ ta thu được dd Ba(OH)2
- Cho Ba(OH)2 lần lượt vào 2 mẫu thử chưa nhận biết được là Mg và Al
+ Kim loại nào thấy khí thoát ra là Al
2Al + 2H2O + Ba(OH)2 → Ba(AlO2)2 + 2H2↑
+ Kim loại nào không có hiện tượng gì là Mg
⇒ Vậy sẽ nhận ra được cả 5 kim loại
Đúng 0
Bình luận (0)
Chỉ dùng thêm dung dịch H2SO4 loãng, có thể nhận biết được bao nhiêu chất trong số các kim loại Al, Mg, Fe, Ag, Ba?
A. 2
B. 3.
C. 4.
D. 5e
Chọn đáp án D.
Chia các kim loại cần nhận biết thành nhiều phần, mỗi thí nghiệm thực hiện với 1 phần:
- Cho H2SO4 loãng vào từng lọ chứa kim loại.
+ Nhận ra: Ag (không hiện tượng) và Ba (vừa có khí không màu thoát ra, vừa xuất hiện kết tủa trắng).
+ 3 kim loại Al, Mg, Fe (đều có khí không màu thoát ra).
- Cho tiếp Ba vào dung dịch H2SO4 loãng, lọc bỏ kết tủa, tiếp tục cho Ba vào và lọc bỏ kết tủa, lặp lại nhiều lần đến khi không còn xuất hiện kết tủa, thu lấy dung dịch nước lọc (chứa Ba(OH)2 được tạo thành sau khi H2SO4 hết. Ba tiếp tục tác dụng với H2O) cho vào dung dịch muối thu được ở trên từ 3 kim loại Al, Mg, Fe.
+ Xuất hiện kết tủa keo trắng sau đó kết tủa tan. Mẫu thử là Al.
+ Xuất hiện kết tủa trắng, không tan. Mẫu thử là Mg.
+ Xuất hiện kết tủa trắng xanh, để trong không khí chuyển thành kết tủa nâu đỏ. Mẫu thử là Fe
Đúng 1
Bình luận (0)
cho 3 kim loại màu trắng bạc: ag,al,mg . trình bày phương trình hoá học nhận biết 3 kim loại trên
Có 5 kim loại là Mg, Ba, Zn, Fe, Ag. Chỉ dùng thêm dung dịch H2SO4 loãng thì có thể nhận biết được các kim loại A. Mg, Ba, Zn, Fe B. Mg, Ba, Zn, Fe, Ag C. Mg, Ba, Zn D. Mg, Ba, Cu
Đọc tiếp
Có 5 kim loại là Mg, Ba, Zn, Fe, Ag. Chỉ dùng thêm dung dịch H2SO4 loãng thì có thể nhận biết được các kim loại
A. Mg, Ba, Zn, Fe
B. Mg, Ba, Zn, Fe, Ag
C. Mg, Ba, Zn
D. Mg, Ba, Cu
Đáp án B.
Dùng H2SO4 loãng :
+) Kết tủa + bọt khí : Ba
+) Kết tủa : Ag
+) Tan + bọt khí : Mg, Zn, Fe
Cho Ba dư vào 3 bình chưa nhận được
+) Kết tủa trắng hóa nâu khoài không khí => Fe
+) Kết tủa trắng :Mg và Zn
Cho Ba dư vào dung dịch H2SO4 => lọc kết tủa => chỉ còn dung dịch Ba(OH)2
Cho 2 kim loại chưa nhận được vào :
+) Kim loại tan + khí : Zn
+) kết tủa : Mg
Đúng 0
Bình luận (0)
Cho các kim loại: Ba, Mg, Fe, Al và Ag. Nếu chỉ dùng H2SO4 loãng, có thể nhận biết được những kim loại nào ở trên?
A. Ba, Mg
B. Fe, Al
C. Al, Ag
D. Cả 5 kim loại
Đáp án D
Hướng dẫn
Trích mẩu thử cho mỗi lần thí nghiệm. Cho dung dịch H2SO4 loãng lần lượt vào các mẩu thử.
- Kim loại không tan là Ag, các kim loại còn lại tan và tạo khí H2 và các dung dịch muối.
- Trường hợp tạo kết tủa là Ba. Lọc bỏ kết tủa rồi lấy dung dịch nước lọc có chứa Ba(OH)2 cho tác dụng với các dung dịch muối ở trên.
+ Dung dịch tạo kết tủa trắng xanh rồi hóa nâu là FeSO4.
=> kim loại ban đầu là Fe.
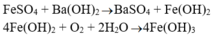
+ Dung dịch tạo kết tủa keo trắng rồi tan dần là Al2(SO4)3 => kim loại
ban đầu là Al.
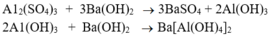
+ Dung dịch tạo kết tủa trắng là MgSO4 => kim loại ban đầu là Mg.
![]()
Đúng 0
Bình luận (0)
Cho các hỗn hợp kim loại sau: (1) Mg – Fe, (2) Mg – K, (3) Mg – Ag, (4) Ca – Be. Chỉ dùng H2O có thể nhận biết được bao nhiêu hỗn hợp kim loại trên ?. A. 1 B. 2 C. 3 D. 4
Đọc tiếp
Cho các hỗn hợp kim loại sau: (1) Mg – Fe, (2) Mg – K, (3) Mg – Ag, (4) Ca – Be. Chỉ
dùng H2O có thể nhận biết được bao nhiêu hỗn hợp kim loại trên ?.
A. 1
B. 2
C. 3
D. 4













