Cho 2,7g nhôm vào bình đựng dung dịch chứa 0.25 mol oxit clohiđric a,tính thế tichd khí hiđro ở điều kiện tiêu chuẩn b,sau phản ứng còn dư chất nào và khối lượng là bao nhiêu gam AI GIÚP VỚI :((

Những câu hỏi liên quan
cho 2,5 gam nhôm vào bình chứa 0,5 mol dung dịch axit sunfuric loãng
a,Viết phương trình phản ứng
b,chất nào còn dư sau phản ứng Tính khối lượng chất dư
c,Tính thể tích khí thoát ra ở điều kiện tiêu chuẩn
\(n_{Al}=\dfrac{2,5}{27}=\dfrac{25}{270}=\dfrac{5}{54}\left(mol\right)\\ n_{H_2SO_4}=0,5\left(mol\right)\\ a,2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ b,Vì:\dfrac{\dfrac{5}{54}}{2}< \dfrac{0,5}{4}\Rightarrow H_2SO_4dư\\ b,n_{H_2SO_4\left(dư\right)}=0,5-\dfrac{3}{2}.\dfrac{5}{54}=\dfrac{13}{36}\left(mol\right)\\ \Rightarrow m_{H_2SO_4}=\dfrac{13}{36}.98=\dfrac{637}{18}\left(g\right)\\ c,n_{H_2}=\dfrac{3}{2}.n_{Al}=\dfrac{3}{2}.\dfrac{5}{54}=\dfrac{5}{36}\left(mol\right)\\ \Rightarrow V_{H_2\left(đktc\right)}=\dfrac{5}{36}.22,4=\dfrac{28}{9}\left(l\right)\)
Đúng 5
Bình luận (2)
Tóm tắt:
mAl= 2,5(g)
\(n_{H_2SO_4}=0,5\left(mol\right)\)
---
a) PTHH?
b) Chất dư? m?
c) Thể tích khí sau phản ứng?
Anh ít tóm tắt lắm nên không biết tóm tắt như ri ổn không, vì em cần nên anh tóm tắt ra thử
Đúng 2
Bình luận (1)
cho 2,5 gam nhôm vào bình chứa 0,25 mol dung dịch axit sunfuric loãng a,Viết phương trình phản ứng b,chất nào còn dư sau phản ứng Tính khối lượng chất dư c,Tính thể tích khí thoát ra ở điều kiện tiêu chuẩn
a: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
b: \(n_{Al}=\dfrac{2.5}{27}< \dfrac{1}{4}\)
=>H2SO4 dư, Al đủ
\(m_{H_2SO_4}=0.25\cdot98=24.5\left(g\right)\)
c: \(n_{Al_2\left(SO_4\right)_3}=\dfrac{2.5}{54}=\dfrac{5}{108}\left(mol\right)\)
\(\Leftrightarrow n_{H_2}=\dfrac{5}{36}\left(mol\right)\)
\(V_{H_2}=\dfrac{5}{36}\cdot22.4=\dfrac{28}{9}\left(lít\right)\)
Đúng 1
Bình luận (0)
Mình thấy bạn Thịnh tính lượng dư sai
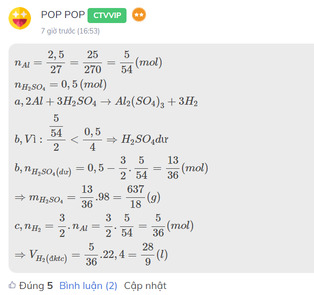
Đây là bài mình từng làm, bạn tham khảo nhé!
Đúng 1
Bình luận (2)
Cho 5,4 gam Nhôm vào bình đựng dung dịch Axit Sunfuric H2SO4 dư thu được dung dịch muối Nhôm Sunfat Al2(SO4)3 và khí Hiđro H2
a) Viết phương trình phản ứng
b )tính thể tích khí H2 sinh ra ở điều kiện tiêu chuẩn
c )Tính khối lượng muối thu được sau phản ứng
d) tính khối lượng axit sunfuric đã dùng
Xem chi tiết
PTHH: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
Làm gộp các phần còn lại
Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}n_{Al_2\left(SO_4\right)_3}=0,1mol\\n_{H_2SO_4}=n_{H_2}=0,3mol\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=0,3\cdot22,4=6,72\left(l\right)\\m_{Al_2\left(SO_4\right)_3}=0,1\cdot342=34,2\left(g\right)\\m_{H_2SO_4}=0,3\cdot98=29,4\left(g\right)\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Cho 32 gam đồng tác dụng với 2,24 lít khí hiđro ở điều kiện tiêu chuẩn.
a/ Tính khối lượng oxit sau phản ứng.
b/ Để dùng sản phẩm ở trên tác dụng với 200 gam dung dịch axit Clohiđric có nồng độ 14,6 % thì sau phản ứng chất nào còn dư, khối lượng bao nhiêu gam ? Tính nồng độ phần trăm của dung dịch sinh ra sau khi phản ứng kết thúc .
Cho 10,5g nhôm tác dụng với 730g dung dịch HCl 20%
a) Chất nào dư và dư bao nhiêu gam? b) Tính khối lượng muối và thể tích khí hidro thu được ở (điều kiện tiêu chuẩn) sau phản ứng
c)Nếu vẫn toàn bộ khí sinh ra vào Bình có chứa 32 g CuO được nung nóng thì thu được bao nhiêu gam đồng?
d) Tính khối lượng P2O5 cần dùng để điều chế oxi đốt cháy hết lượng khí H2 trên
Cho 13 gam kẽm vào bình đựng dung dịch axit clohiđric dư. a, Tính thể tích khí hiđrô thu được ở đktc. b, Cho toàn bộ khí hiđro thu được đi qua 6,4 gam Fe2O3 đang nung nóng . Hỏi - Chất nào còn dư sau phản ứng ? khối lượng dư là bao nhiêu? - Tính khối lượng sắt thu được sau phản ứng. ( Biết khối lượng mol của Zn= 65, Cl = 35,5, O = 16, Fe = 56)
a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Zn}=0,2\left(mol\right)\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b, \(n_{Fe_2O_3}=\dfrac{6,4}{160}=0,04\left(mol\right)\)
PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Xét tỉ lệ: \(\dfrac{0,04}{1}< \dfrac{0,2}{3}\), ta được H2 dư.
Theo PT: \(n_{H_2\left(pư\right)}=3n_{Fe_2O_3}=0,12\left(mol\right)\Rightarrow n_{H_2\left(dư\right)}=0,2-0,12=0,08\left(mol\right)\)
\(\Rightarrow m_{H_2\left(dư\right)}=0,08.2=0,16\left(g\right)\)
Theo PT: \(n_{Fe}=2n_{Fe_2O_3}=0,08\left(mol\right)\Rightarrow m_{Fe}=0,08.56=4,48\left(g\right)\)
Đúng 1
Bình luận (0)
Ngâm một lá nhôm có khối lượng là 0,81 gam vào dung dịch chứa 1,825 gam HCl đến khi phản ứng kết thúc
a,Thể tích khí hiđro thu được ở điều kiện tiêu chuẩn là bao nhiêu mililit
b,Nếu lấy khối lượng dung dịch sau phản ứng đem cân thì thấy khối lương jtăng hay giảm so với khối lượng dungg dịch HCl ban đầu là bao nhiêu gam ?
a) $n_{Al} = \dfrac{0,81}{27} = 0,03(mol) ; n_{HCl} = \dfrac{1,825}{36,5} = 0,05(mol)$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
Vì :
$n_{Al} : 2 > n_{HCl} : 6$ nên Al dư
$n_{H_2} = \dfrac{1}{2}n_{HCl} = 0,025(mol)$
$V_{H_2} = 0,025.24,79 = 0,61975(lít)$
b) $n_{Al\ pư} = \dfrac{1}{3} n_{HCl} = \dfrac{0,05}{3}(mol)$
Ta thấy : $m_{Al} - m_{H_2} = \dfrac{0,05}{3}.27 - 0,025.2 = 0,4 > 0$
Do đó, dung dịch tăng so với khối lượng dung dịch HCl ban đầu 0,4 gam
Đúng 1
Bình luận (0)
Câu 4. Đốt cháy 6,2 gam photpho trong bình chứa 7,84 lít khí oxi ở điều kiện tiêu chuẩn
a/ Chất nào còn dư sau phản ứng và dư bao nhiêu gam?
b/ Tính khối lượng sản phẩm tạo thành sau phản ứng.
nP=\(\dfrac{62}{31}\)=0,2(mol)
nO2=\(\dfrac{7,84}{22,4}\)=0,35(mol)
PTHH:4P+5O2to→2P2O5
tpứ: 0,2 0,35
pứ: 0,2 0,25 0,1
spứ: 0 0,1 0,1
a)chất còn dư là oxi
mO2dư=0,1.32=3,2(g)
b)mP2O5=n.M=0,1.142=14,2(g)
Đúng 1
Bình luận (0)
\(a.n_P=0,2\left(mol\right);n_{O_2}=0,35\left(mol\right)\\ 4P+5O_2-^{t^o}\rightarrow2P_2O_5\\ LTL:\dfrac{0,2}{4}< \dfrac{0,35}{5}\\ \Rightarrow SauphảnứngO_2dư\\ n_{O_2\left(pứ\right)}=\dfrac{5}{4}n_P=0,25\left(mol\right)\\ \Rightarrow m_{P\left(dư\right)}=\left(0,35-0,25\right).32=3,2\left(g\right)\\ b.n_{P_2O_5}=\dfrac{1}{2}n_P=0,1\left(mol\right)\\ \Rightarrow m_{P_2O_5}=0,1.142=14,2\left(g\right)\)
Đúng 0
Bình luận (0)
a) n\(_P\) = \(\dfrac{6,2}{31}\) = 0,2(mol); n\(_{O_2}\) = \(\dfrac{7,84}{22,4}\) = 0,35(mol).
Theo phương trình hóa học:
\(4P+5O_2\) \(\underrightarrow{t^o}\) \(2P_2O_5\)
4 5 2 (mol)
0,2 \(\rightarrow\)0,25 \(\rightarrow\) 0,1(mol)
Tỉ lệ số mol: \(\dfrac{0,2}{4}< \dfrac{0,35}{5}\) \(\Rightarrow\) \(O_2\) phản ứng dư, P phản ứng hết.
\(n_{O_2}\)dư = 0,35 - \(\dfrac{0,2.5}{4}\) = 0,1(mol) \(\Rightarrow\) \(m_{O_2}\)dư = 0,1.32 = 3,2g
b) \(n_{P_2O_5}\) = 0,1.142 = 14,2g
Đúng 0
Bình luận (0)
Cho 6,5 g kẽm vào bình dung dịch chứa 0,25 mol axit clohiđric.
a/ Tính thể tích khí hiđro thu được ở đktc?
b. Sau phản ứng còn dư chất nào ? khối lượng là bao nhiêu gam?
PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\n_{HCl}=0,25\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,25}{2}\) \(\Rightarrow\) HCl còn dư, Kẽm p/ứ hết
\(\Rightarrow\left\{{}\begin{matrix}n_{H_2}=0,1\left(mol\right)\\n_{HCl\left(dư\right)}=0,05\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=22,4\cdot0,1=2,24\left(l\right)\\m_{HCl\left(dư\right)}=0,05\cdot36,5=1,825\left(g\right)\end{matrix}\right.\)
Đúng 3
Bình luận (0)