
Những câu hỏi liên quan
làm sao để viết hổn số, chỉ mình với!!!
mk pít đó
bn nhấ vào chứ fx rùi ghi 1 số trc sau đó chọn vào phần phân số là đc nhá
VD mk mún mún viết hỗn số \(1\frac{1}{1}\) thì lm thế đó
mk nhá bn
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
2/3 đổi thành hổn số
0 va 2/3 dung thi h cho minh nhe !Thank you
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
để 14,8g hổn hợp gồm Fe và Cu trong khí O2 ,sau một thời gian thu được 19,2g hổn hợp X gồm CuO , Fe2O3 ,FeO ,Fe3O4 .Hổn hợp X tác dụng vừa đủ với m gam axit HCl . a, viết PTHH. b, tính thể tích khí O2 ( đktc) đã phản ứng. c, tính m
a)
$4Fe + 3O_2 \xrightarrow{t^o} 2Fe_2O_3$
$2Fe + O_2 \xrightarrow{t^o} 2FeO$
$3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4$
$2Cu + O_2 \xrightarrow{t^o} 2CuO$
Bảo toàn khối lượng : $m_{O_2} = 19,2 - 14,8 = 4,4(gam)$
$n_{O_2} = \dfrac{4,4}{32} = 0,1375(mol)$
$V_{O_2} = 0,1375.22,4= 3,08(lít)$
b)
Bản chất của phản ứng cho X vào HCl là O trong hỗn hợp X kết hợp với H trong axit tạo thành nước
$2H + O \to H_2O$
$\Rightarrow n_{HCl} = n_H = 2n_O = 0,275(mol)$
$m = 0,275.36,5 = 10,0375(gam)$
Đúng 1
Bình luận (1)
Cho V lít hổn hợp khí X gồm H2, C2H2, C2H4 , trong đó số mol của C2H2 bằng số mol của C2H4 đi qua Ni nung nóng (hiệu suất đạt 100%) thu được 11,2 lít hỗn hợp khí Y (ở đktc), biết tỷ khối hơi của hổn hợp Y đối với H2 là 6,6. Nếu cho V lít hổn hợp X đi qua dung dịch Brom dư thì khối lượng bình Brom tăng A. 5,4 gam B. 2,7 gam C. 6,6 gam D. 4,4 gam
Đọc tiếp
Cho V lít hổn hợp khí X gồm H2, C2H2, C2H4 , trong đó số mol của C2H2 bằng số mol của C2H4 đi qua Ni nung nóng (hiệu suất đạt 100%) thu được 11,2 lít hỗn hợp khí Y (ở đktc), biết tỷ khối hơi của hổn hợp Y đối với H2 là 6,6. Nếu cho V lít hổn hợp X đi qua dung dịch Brom dư thì khối lượng bình Brom tăng
A. 5,4 gam
B. 2,7 gam
C. 6,6 gam
D. 4,4 gam
Đáp án A
Đặt x, y, y lần lượt là số mol của H2, C2H2, C2H4
MY = 2.6,6 = 13,2 < MC2H2
èY chứa H2 dư (x - 3y mol) và C2H6 (2y mol)
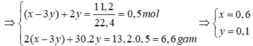
Đúng 0
Bình luận (0)
A=8 2/7-(3 4/9 + 4 2/7) giúp mình với câu này là phép cộng, trừ hổn số. Thank you very much!
Đốt cháy 5( g ) hổn hợp cacbon và lưu huỳnh trong bình khí O2 dư, thu được 1,3g hổn hợp sp . Tính VO2 ( đkc ) cần dùng
*Sửa đề: Thu được 13g hh sản phẩm
Bảo toàn khối lượng: \(m_{O_2\left(p.ứ\right)}=m_{hỗn.hợp}-\left(m_C+m_S\right)=13-5=8\left(g\right)\)
\(\Rightarrow n_{O_2}=\dfrac{8}{32}=0,25\left(mol\right)\) \(\Rightarrow V_{O_2}=0,25\cdot22,4=5,6\left(l\right)\)
Đúng 2
Bình luận (0)
B5:Cho 20,9g hổn hợp gồm Al2O3,Mgo,Al phản ứng vừa đủ với 650ml dung dịch HCL 2M phản ứng kết thúc thu đc 3,36L khí ĐKTC a:Tính khối lượng mổi chất trong hổn hợp ban đầu b:Tính nồng độ mol của các muối sau phản ứng,có V dung dịch ko thay đổi
\(n_{HCl}=0,65.2=1,3\left(mol\right)\)
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\) (1)
0,1<----0,3<------0,1<-----0,15
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\) (2)
x--------->6x-------->2x
\(MgO+2HCl\rightarrow MgCl_2+H_2O\) (3)
y--------->2y-------->y
Gọi \(\left\{{}\begin{matrix}n_{Al_2O_3}=x\left(mol\right)\\n_{MgO}=y\left(mol\right)\end{matrix}\right.\)
Theo PTHH (1), (2), (3) có:
\(n_{HCl\left(2\right)}+n_{HCl\left(3\right)}=n_{HCl.ban.đầu}-n_{HCl\left(1\right)}\\ \Leftrightarrow6x+2y=1,3-0,3=1\left(mol\right)\left(I\right)\)
Theo PTHH (1) có: \(m_{Al}=0,1.27=2,7\left(g\right)\\ \Rightarrow m_{Al_2O_3}+m_{MgO}=102x+40y=20,9-2,7=18,2\left(g\right)\left(II\right)\)
Từ (I),(II) có hệ phương trình:
\(\left\{{}\begin{matrix}6x+2y=1\\102x+40y=18,2\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
Trong hỗn hợp ban đầu:
\(\left\{{}\begin{matrix}m_{Al}=2,7\left(g\right)\\m_{Al_2O_3}=102x=102.0,1=10,2\left(g\right)\\m_{MgO}=40y=40.0,2=8\left(g\right)\end{matrix}\right.\)
b
\(CM_{AlCl_3}=\dfrac{0,1+2x}{0,65}=\dfrac{0,1+2.0,1}{0,65}=\dfrac{6}{13}\approx0,46M\)
\(CM_{MgCl_2}=\dfrac{y}{0,65}=\dfrac{0,2}{0,65}=\dfrac{4}{13}\approx0,31M\)
Đúng 1
Bình luận (0)
viết 5 số thập phân bằng hổn số 3 và 4/5
3,8 ; 3,80 ; 3,800 ; 3,8000 ; 3,80000
mình nhanh nhất k và kết bạn với mình nha
Đúng 0
Bình luận (0)
câu 6 : Đốt 22,8g hổn hợp CuS và FeS trong O2 dư thu hổn hợp Oxit và 5,6 lít SO2 ( đkt ) a. viết PTHH b. Tính % khối lượng mỗi Oxit trong h2 rắn
PTHH: \(2CuS+3O_2\xrightarrow[]{t^o}2CuO+2SO_2\uparrow\)
a____________a_______a (mol)
\(4FeS+7O_2\xrightarrow[]{t^o}2Fe_2O_3+4SO_2\)
2b_____________b_______2b (mol)
Ta lập hệ phương trình: \(\left\{{}\begin{matrix}96a+88\cdot2b=22,8\\a+2b=\dfrac{5,6}{22,4}=0,25\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,075\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CuO}=\dfrac{0,1\cdot80}{0,1\cdot80+0,075\cdot160}\cdot100\%=40\%\\\%m_{Fe_2O_3}=60\%\end{matrix}\right.\)
Đúng 3
Bình luận (0)
a, \(n_{SO_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: CuS + O2 ---to--> CuO + SO2
Mol: x x
PTHH: FeS + O2 ---to→ FeO + SO2
Mol: 0,25-x 0,25-x
Ta có: mFeS + mCuS = 22,8
⇔ (0,25-x).88 + x.96 = 22,8
⇔ 22-88x+96x=22,8
⇔ 8x=0,8
⇔ x=0,1
PTHH: CuS + O2 ---to--> CuO + SO2
Mol: 0,1 0,1 0,1
PTHH: FeS + O2 ---to→ FeO + SO2
Mol: 0,15 0,15 0,15
mhh = 0,1.96+0,15.88=22,8 (g)
⇒ \(\%m_{FeO}=\dfrac{0,15.88.100\%}{22,8}=57,9\%;\%m_{CuO}=\dfrac{0,1.96.100\%}{22,8}=42,1\%\)
Đúng 0
Bình luận (0)
























