Khi thu các khí sau \(CH_4,O_2,Cl_2,N_2\) bằng cách đặt đứng bình hay đặt ngược bình

Những câu hỏi liên quan
Hãy cho biết khí hidro và khí oxi nặng hay nhẹ hơn không khí , tại sao? Có thể thu khí hidro và khí oxi vào bình ( từ những thí nghiệm trong phòng thí nghiệm ) bằng cách đặt đứng bình hay đặt ngược bình và giải thích ?
Xem chi tiết
Hidro nhẹ hơn không khí vì (d\(\dfrac{H_2}{kk}\)= \(\dfrac{2}{29}\)<1)
Oxi nặng hơn không khí vì (d\(\dfrac{O_2}{kk}\)=\(\dfrac{32}{29}\)>1)
Để thu được khí hidro khi điều chế cần đặt úp bình vì khí hidro nhẹ hơn không khí ,nếu ngửa bình hidro sẽ bay ra khỏi bình .
Ngược lại để thu được khí oxi khi điều chế cần ngửa bình vì oxi nặng hơn không khí sẽ lắng xuống đáy bình , nếu úp bình oxi sẽ lắng xuống và thoát ra khỏi bình
Đúng 1
Bình luận (0)
Câu 6: Trong phòng thí nghiệm, có thể thu khí carbonic vào bình bằng cách đẩy không khí. Hãy cho biết trong trường hợp này phải đặt đứng bình hay ngược bình? Giải thích?
Theo mình là đặt đứng bình. Vì CO2 nặng hơn không khí
\(d_{\dfrac{CO_2}{kk}}=\dfrac{44}{29}\approx1,52\)
Đúng 6
Bình luận (0)
Đứng bình. Giải thích:
\(d_{CO_2\text{/}kk}=\dfrac{M_{CO_2}}{29}=\dfrac{44}{29}\approx1,52\)
=> CO2 nặng hơn không khí 1,52 lần => CO2 ở dưới nên phải đặt đứng bình để thu được khí.
Đúng 3
Bình luận (0)
Có 2 cách thu khí: a) Đặt đứng bình b) Đặt ngược bìnhCó thể thu khí H2, Cl2, O2, SO2 vào bình nào trong 2 bình trên? Vì sao?(Lưu ý: khí nào nặng hơn không khí thì rớt xuống nên thu bằng cách a), khí nào nhẹ hơn không khí thì bay lên nên thu bằng cách b))
Đọc tiếp
Có 2 cách thu khí:
a) Đặt đứng bình b) Đặt ngược bình
Có thể thu khí H2, Cl2, O2, SO2 vào bình nào trong 2 bình trên? Vì sao?
(Lưu ý: khí nào nặng hơn không khí thì rớt xuống nên thu bằng cách a), khí nào nhẹ hơn không khí thì bay lên nên thu bằng cách b))
Có thể thu những khí nào vào bình (từ những thí nghiệm trong phòng thí nghiệm) khí hiđro, khí clo, khí cacbon đioxit, khí metan bằng cách:
a) Đặt đứng bình.
b) Đặt ngược bình.
Giải thích việc làm này?
Ta có:
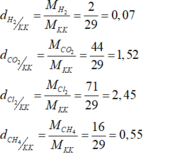
a) Đặt ngửa bình thu được những khí có tỉ khối đối với không khí lớn hơn 1
- Khí clo nặng hơn không khí 2,45 lần
- Khí cacbon đioxit nặng hơn không khí 1,52 lần
b) Đặt úp bình thu được những khí còn lại có tỉ khối đối với không khí nhỏ hơn 1:
- Khí hiđro nhẹ hơn không khí và bằng 0,07 lần không khí
- Khí metan CH4 nhẹ hơn không khí và bằng 0,55 lần không khí.
Đúng 0
Bình luận (0)
I. TRẮC NGHIỆM KHÁCH QUAN (4 điểm)Đọc các câu sau và ghi chữ cái đứng trước vào câu trả lời đúng nhất vào bảng sau.Câu 1: Muốn thu khí NH3 vào bình thì thu bằng cách:A. Đặt úp ngược bìnhB. Đặt đứng bìnhC. Cách nào cũng đượcD. Đặt nghiêng bìnhCâu 2: Tỉ khối của khí A đối với khí nitơ (N2) là 1,675 .Vậy khối lượng mol của khí A tương đương:A. 45gB. 46gC.47gD.48gCâu 3: Thành phần phần trăm theo khối lượng của nguyên tố S trong hợp chất SO2 là:A. 40%B. 60%C. 20%D. 80%Câu 4: “Chất biến đổi trong phản...
Đọc tiếp
I. TRẮC NGHIỆM KHÁCH QUAN (4 điểm)
Đọc các câu sau và ghi chữ cái đứng trước vào câu trả lời đúng nhất vào bảng sau.
Câu 1: Muốn thu khí NH3 vào bình thì thu bằng cách:
A. Đặt úp ngược bình
B. Đặt đứng bình
C. Cách nào cũng được
D. Đặt nghiêng bình
Câu 2: Tỉ khối của khí A đối với khí nitơ (N2) là 1,675 .Vậy khối lượng mol của khí A tương đương:
A. 45g
B. 46g
C.47g
D.48g
Câu 3: Thành phần phần trăm theo khối lượng của nguyên tố S trong hợp chất SO2 là:
A. 40%
B. 60%
C. 20%
D. 80%
Câu 4: “Chất biến đổi trong phản ứng là.........., còn chất mới sinh ra gọi là.........”
A. chất xúc tác – sản phẩm
B. chất tham gia – chất phản ứng
C. chất phản ứng – sản phẩm
D. chất xúc tác – chất tạo thành
Câu 5: Đun nóng đường, đường chảy lỏng. Đây là hiện tượng:
A. vật lý
B. hóa học
C. sinh học
D. tự nhiên
Câu 6: Thể tích mol của chất khí là thể tích chiếm bởi N….. của khí đó. Từ thích hợp là:
A. nguyên tử
B. số mol
D. khối lượng
D.phân tử
Câu 7: Cho các khí sau: N2, H2, CO, SO2, khí nào nặng hơn không khí ?
A. Khí N2
B. Khí H2
C. Khí CO
D. Khí SO2
Câu 8: Số mol của 0,56 gam khí nitơ là:
A. 0,01 mol
B. 0,02 mol
C. 0,025 mol
D. 0,1 mol
Câu 9: Cho phương trình: Cu + O2→ CuO. Phương trình cân bằng đúng là:
A. 2Cu + O2 → CuO
B. Cu + O2 → 2CuO
C. 2Cu + 2O2→ 4CuO
D. 2Cu + O2 → 2CuO
Câu 10: Phát biểu nào sau đây là đúng ?
A. Thủy tinh nóng chảy thổi thành bình cầu là hiện tượng hóa học
B. Công thức hóa học của Fe(III) và O(II) là Fe3O2
C. Ở điều kiện tiêu chuẩn, 1 mol chất khí có thể tích là 22,4 lít
D. Nguyên tử cùng loại có cùng số proton và số nơtron trong hạt nhân
Câu 11: Trong các phương trình sau, phương trình nào cân bằng sai ?
A. 2Fe + 3Cl2→ 2FeCl3
B. 2H2 + O2 → 2H2O
C. 2Al + 3O2 → 2Al2O3
D. Zn + 2HCl → ZnCl2 + H2
II. TỰ LUẬN ( 6 điểm)
Câu 1( 1 điểm)Tính số mol của:
a) 142g Cl2;
b) 41,1 g H2SO4;
c) 9.1023 phân tử Na2CO3;
d)16,8 lít khí CO2 (đktc)
Câu 2: (1,5 điểm) Cân bằng các phương trình sau:
a) K + O2 ---> K2O
b) NaOH + Fe2(SO4)3 ---> Fe(OH)3 + Na2SO4
c) BaCl2 + AgNO3 ---> AgCl + Ba(NO3)2
Câu 3 (1,5 điểm) Một hợp chất khí có thành phần phần trăm theo khối lượng là 82,35% N và 17,65 % H Hãy cho biết công thức hóa học của hợp chất. Biết hợp chất này có tỉ khối với khí hiđro là 8,5.
Câu 4 (1 điểm) Đốt cháy 18g kim loại magie Mg trong không khí thu đuợc 30g hợp chất magie oxit (MgO). Biết rằng Mg cháy là xảy ra phản ứng với khí oxi trong không khí.
a) Viết công thức về khối lượng của phản ứng.
b) Tính khối lượng khí oxi đã phản ứng.
Câu 5 (1 điểm) Hợp chất D có thành phần là: 7 phần khối lượng nitơ kết hợp với 20 phần khối lượng oxi. Tìm công thức hóa học của hợp chất D.
(Biết N = 14; H=1;C= 12; O= 16; S= 32; Cl= 35,5; Na = 23)
Câu 5: Tính khối lượng của:a) 0,2 mol CaCl2b) 2,479 lit khí CO2 (đkc)Câu 6: Trong phòng thí nghiệm, có thể thu khí oxygen vào bình bằng cách đẩy không khí. Hãy cho biết trong trường hợp này phải đặt đứng bình hay ngược bình? Giải thích?
Đọc tiếp
Câu 5: Tính khối lượng của:
a) 0,2 mol CaCl2
b) 2,479 lit khí CO2 (đkc)
Câu 6: Trong phòng thí nghiệm, có thể thu khí oxygen vào bình bằng cách đẩy không khí. Hãy cho biết trong trường hợp này phải đặt đứng bình hay ngược bình? Giải thích?
Câu 5:
\(a,m_{CaCl_2}=n_{CaCl_2}.M_{CaCl_2}=0,2.111=22,2\left(g\right)\\ b,n_{CO_2\left(ĐKC\right)}=\dfrac{2,479}{24,79}=0,1\left(mol\right)\)
Câu 6: Úp đứng bình vì khí O2 nặng hơn không khí. (32>29)
Đúng 1
Bình luận (0)
Cho một số chất khí sau: H2, Cl2, O2, N2, CO2. Khi thu mỗi khí trên vào bình bằng cách đẩy không khí ta phải đặt ngửa bình hay đặt úp bình? Giải thích?
Khí $H_2,N_2$ khi thu trên bình bằng cách đẩy không khí ta phải đặt úp bình
Khí $Cl_2,O_2,CO_2$ khi thu trên bình bằng cách đẩy không khí ta phải đặt ngửa bình
Đúng 2
Bình luận (0)
Có pt 2Hcl+MgCO3→MgCl2+Co2+H2O
Tính mMgCl2 thu được khi cho 8,4g MgCO3 tác dụng với HCL dư
Tính V CO2 thu được ở dktc nếu có 7,3g HCL tham gia phản ứng
Thu Khí CO2 bằng cách đặt đứng bình hay ngược binh?Vì Sao
PTHH: MgCO3 +2 HCl -> MgCl2 + CO2 + H2O
a) nMgCO3=8,4/84=0,1(mol)
=> nMgCl2=nMgCO3=0,1(mol) => mMgCl2=0,1.95=9,5(g)
b) nHCl=7,3/36,5=0,2(mol)
=> nCO2= 1/2. nHCl=1/2. 0,2=0,1(mol) => V(CO2,đktc)=0,1.22,4=2,24(l)
c) Thu khí CO2 ta thu bằng cách đặt đứng bình vì khí CO2 là khí nặng hơn không khí (44>29)
Đúng 1
Bình luận (0)
Cân bằng các phản ứng sau bằng phương pháp thăng bằng electron.
a) \(N_2+O_2\rightarrow NO\)
b) \(C_2H_5OH+O_2\rightarrow CO_2+H_2O\)
c) \(CH_4+O_2\rightarrow CO_2+H_2O\)
d) \(H_2S+O_2\rightarrow H_2O+SO_2\)
e) \(NH_3+O_2\rightarrow N_2+H_2O\)
a) \(N_2+O_2\rightarrow2NO\)
\(\begin{matrix}N^0\rightarrow N^{+2}+2e\\O^0+2e\rightarrow O^{-2}\end{matrix}|\begin{matrix}\times1\\\times1\end{matrix}\)
b) \(C_2H_5OH+3O_2\rightarrow2CO_2+3H_2O\)
\(\begin{matrix}C^{-2}\rightarrow C^{+4}+6e\\O^0+2e\rightarrow O^{-2}\end{matrix}|\begin{matrix}\times1\\\times3\end{matrix}\)
c) \(CH_4+2O_2\rightarrow CO_2+2H_2O\)
\(\begin{matrix}C^{-4}\rightarrow C^{+4}+8e\\O^0+2e\rightarrow O^{-2}\end{matrix}|\begin{matrix}\times1\\\times4\end{matrix}\)
d) \(2H_2S+3O_2\rightarrow2H_2O+2SO_2\)
\(\begin{matrix}S^{-2}\rightarrow S^{+4}+6e\\O^0+2e\rightarrow O^{-2}\end{matrix}|\begin{matrix}\times1\\\times3\end{matrix}\)
e) \(4NH_3+3O_2\rightarrow2N_2+6H_2O\)
\(\begin{matrix}N^{-3}\rightarrow N^0+3e\\O^0+2e\rightarrow O^{-2}\end{matrix}|\begin{matrix}\times2\\\times3\end{matrix}\)
Đúng 0
Bình luận (0)
a)N2+O2->2NO
b)C2H5OH+3O2->2CO2+3H2O
c)CH4+2O2->CO2+2H2O
d)H2S+3/2O2->H2O+SO2 / 2H2S+3O2->2H2O+2SO2
e)2NH3+3/2O2->N2+3H2O / 4NH3+3O2->2N2+6H2O
CHÚC BN HỌC TỐT :))))























