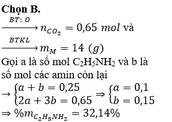đốt cháy hết m gam bột sắt cần đủ 3,36 dm khối khí Oxi ở điều kiện tiêu chuẩn Tính m

Những câu hỏi liên quan
Đốt cháy hoàn toàn 2,52 gam sắt ở nhiệt độ cao. a/ Tính thể tích khí oxi ở điều kiện tiêu chuẩn cần dùng. b/ Để có lượng oxi trên cần phải phân hủy bao nhiêu gam KCIO3. c/ Tính khối lượng O2, cần để đốt cháy hoàn toàn lượng khí vừa sinh ra ở trên?
\(a/n_{Fe}=\dfrac{2,52}{56}=0,045mol\\ 3Fe+2O_2\xrightarrow[]{t^0}Fe_3O_4\\ n_{O_2}=\dfrac{0,045.2}{3}=0,03mol\\ V_{O_2}=0,03.22,4=0,672l\\ b/2KClO_3\xrightarrow[]{t^0}2KCl+3O_2\\ n_{KClO_3}=\dfrac{0,03.2}{3}=0,02mol\\ m_{KClO_3}=0,02.122,5=2,45g\)
Đúng 2
Bình luận (2)
đốt cháy hết 1,68 gam sắt trong không khí thu được oxit sắt từ a tính khối lượng sản phẩm tạo thành và thể tích không khí cần dùng ở (điều kiện tiêu chuẩn)biết rằng thể tích oxi bằng 1/5 thể tích không khí b tính khối lượng KClO3 cần dùng để thu được lượng khí oxi cho phản ứng trên
\(n_{Fe}=\dfrac{1,68}{56}=0,03\left(mol\right)\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,03 0,02 0,01 ( mol )
\(m_{Fe_3O_4}=0,01.232=2,32\left(g\right)\)
\(V_{kk}=0,02.22,4.5=2,24\left(l\right)\)
\(2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\)
\(\dfrac{1}{75}\) 0,02 ( mol )
\(m_{KClO_3}=\dfrac{1}{75}.122,5=1,63\left(g\right)\)
Đúng 1
Bình luận (0)
a,nFe=1,68/56=0,03 mol
Ta có PTHH : 3Fe + 2O2 --> Fe3O4 (1) ( ở trên dấu --> có to nha )
Theo PTHH ta có :
nFe3O4=1/3nFe=1/3.0,03=0,01 mol
nO2=2/3nFe=2/3.0,03=0,02 mol
=>mFe3O4= 0,01.232=2,32g
=>Vkk=5.(0,02.22,4)=2,24 l
b, Ta có PTHH: 2KClO3 --> 2KCl + 3O2 (2) ( trên dấu --> vẫn có to )
Gọi x là số mol KClO3 cần dùng ( x > 0 )
Theo PTHH (3) và theo bài ra ta có PTHH sau:
2/3x=0,02
=> x=0,03 mol
=> mKClO3= 0,03.122,5= 3,675g
![]()
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 16,8 gam sắt trong không khí
a) Tính khối lượng sản phẩm thu được
b) Tính thể tích khí oxi, và thể tích không khí cần dùng ở điều kiện tiêu chuẩn ( biết oxi chiếm 20% thể tích không khí)
c) Tính khối lượng KMnO4 cần dùng để điều chế đủ oxi cho phản ứng trên? Biết rằng lượng oxi thu được hao hụt 20%
a) nFe = 16,8/56 = 0,3 (mol)
PTHH: 3Fe + 2O2 -> (t°) Fe3O4
Mol: 0,3 ---> 0,2 ---> 0,1
mFe3O4 = 0,1 . 232 = 23,2 (g)
b) VO2 = 0,2 . 22,4 = 4,48 (l)
Vkk = 4,48 . 5 = 22,4 (l)
c) H = 100% - 20% = 80%
nO2 (LT) = 0,2 : 80% = 0,25 (mol)
PTHH: 2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
nKMnO4 = 0,25 . 2 = 0,5 (mol)
mKMnO4 = 0,5 . 158 = 79 (g)
Đúng 4
Bình luận (0)
Đốt cháy sắt trong bình chứa oxi người ta thu được 23,2 gam oxit sắt từ. ( Biết các khí đo ở điều kiện tiêu chuẩn)a. Viết PTHH xảy ra? Tính khối lượng sắt tham gia phản ứng.b. Tính thể tích oxi và thể tích không khí cần dụng cho phản ứng trên biết oxi chiếm 20% thể tích không khí.c.Tính số gam kalipemanganat KMnO4 cần dùng để có đủ lượng oxi dùng cho phản ứng trên, biết rằng hiệu suất của phản ứng phân hủy đạt 85%.
Đọc tiếp
Đốt cháy sắt trong bình chứa oxi người ta thu được 23,2 gam oxit sắt từ. ( Biết các khí đo ở điều kiện tiêu chuẩn)
a. Viết PTHH xảy ra? Tính khối lượng sắt tham gia phản ứng.
b. Tính thể tích oxi và thể tích không khí cần dụng cho phản ứng trên biết oxi chiếm 20% thể tích không khí.
c.Tính số gam kalipemanganat KMnO4 cần dùng để có đủ lượng oxi dùng cho phản ứng trên, biết rằng hiệu suất của phản ứng phân hủy đạt 85%.
\(n_{Fe_3O_4}=\dfrac{m_{Fe_3O_4}}{M_{Fe_3O_4}}=\dfrac{23,2}{232}=0,1mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,3 0,2 0,1 ( mol )
\(m_{Fe}=n_{Fe}.M_{Fe}=0,3.56=16,8g\)
\(V_{O_2}=n_{O_2}.22,4=0,2.22,4=4,48l\)
\(V_{kk}=\dfrac{4,48.100}{20}=22,4l\)
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,4 0,2 ( mol )
\(n_{KMnO_4}=\dfrac{0,4}{85\%}=\dfrac{8}{17}mol\)
\(m_{KMnO_4}=n_{KMnO_4}.M_{KMnO_4}=\dfrac{8}{17}.158=74,3529g\)
Đúng 3
Bình luận (0)
3Fe+2O2-to>Fe3O4
0,3------0,2-------0,1mol
n Fe3O4=\(\dfrac{23,2}{232}\)=0,1 mol
->m Fe=0,3.56=16,8g
b)
VO2=0,2.22,4=4,48l
=>Vkk=4,48.5=22,4l
c)2KMnO4-to>K2MnO4+MnO2+O2
0,4-------------------------------------0,2
=>m KMnO4=0,4.158.\(\dfrac{100}{85}\)=74,35g
Đúng 2
Bình luận (0)
đã dùng hết 3,36 lít khí Oxi điều kiện tiêu chuẩn để đốt cháy khí metan CH4 . Hỏi thể tích khí CH4 điều kiện tiêu chuẩn đã tiêu thụ khi dùng hết lượng oxi đã cho
CH4+2O2-to>CO2+2H2O
0,075---0,15
n O2=\(\dfrac{3,36}{22,4}\)=0,15 mol
=>VCH4=0,075.22,4=1,68l
Đúng 3
Bình luận (0)
\(n_{O_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
0,075 0,15 ( mol )
\(V_{CH_4}=0,075.22,4=1,68l\)
Đúng 0
Bình luận (0)
\(n_{O_2}=\dfrac{3,36}{22,4}=0,15mol\)
CH4 + 2O2 \(\underrightarrow{t^o}\) CO2 + 2H2O
0,075 0,15 ( mol )
\(V_{CH_4}=0,075.22,4=1,68l\)
Đúng 1
Bình luận (4)
Xem thêm câu trả lời
tính thể tích không khí (điều kiện tiêu chuẩn) cần dùng để đốt cháy hết 4,2 sắt biết không khí có 21%khí oxi
Xem chi tiết
PTHH: \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
Ta có: \(n_{Fe}=\dfrac{4,2}{56}=0,075\left(mol\right)\) \(\Rightarrow n_{O_2}=0,05\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,05\cdot22,4=1,12\left(l\right)\) \(\Rightarrow V_{kk}=\dfrac{1,12}{21\%}\approx5,33\left(l\right)\)
Đúng 2
Bình luận (0)
Hỗn hợp M gồm C2H5NH2, CH2CHCH2NH2, H2NCH2CH2CH2NH2, CH3CH2CH2NH2 và CH2CH2NHCH3. Đốt cháy hoàn toàn 5,6 lít M, cần dùng vừa đủ 25,76 lít O2, chỉ thu được CO2; 18 gam H2O và 3,36 lít N2. Các thể tích khí đều đo ở điều kiện tiêu chuẩn. Phần trăm khối lượng của C2H5NH2 trong M là A. 24,11%. B. 32,14%. C. 48,21%. D. 40,18%.
Đọc tiếp
Hỗn hợp M gồm C2H5NH2, CH2=CHCH2NH2, H2NCH2CH2CH2NH2, CH3CH2CH2NH2 và CH2CH2NHCH3. Đốt cháy hoàn toàn 5,6 lít M, cần dùng vừa đủ 25,76 lít O2, chỉ thu được CO2; 18 gam H2O và 3,36 lít N2. Các thể tích khí đều đo ở điều kiện tiêu chuẩn. Phần trăm khối lượng của C2H5NH2 trong M là
A. 24,11%.
B. 32,14%.
C. 48,21%.
D. 40,18%.
Hỗn hợp M gồm C2H5NH2, CH2CHCH2NH2, H2NCH2CH2CH2NH2, CH3CH2CH2NH2 và CH3CH2NHCH3. Đốt cháy hoàn toàn 5,6 lít M, cần dùng vừa đủ 25,76 lít O2, chỉ thu được CO2; 18 gam H2O và 3,36 lít N2. Các thể tích khí đều đo ở điều kiện tiêu chuẩn. Phần trăm khối lượng của C2H5NH2 trong M là A. 48,21%. B. 24,11%. C. 40,18%. D. 32,14%.
Đọc tiếp
Hỗn hợp M gồm C2H5NH2, CH2=CHCH2NH2, H2NCH2CH2CH2NH2, CH3CH2CH2NH2 và CH3CH2NHCH3. Đốt cháy hoàn toàn 5,6 lít M, cần dùng vừa đủ 25,76 lít O2, chỉ thu được CO2; 18 gam H2O và 3,36 lít N2. Các thể tích khí đều đo ở điều kiện tiêu chuẩn. Phần trăm khối lượng của C2H5NH2 trong M là
A. 48,21%.
B. 24,11%.
C. 40,18%.
D. 32,14%.
Đốt cháy a gam S thì cần dùng 11,2 l khí Oxi ở điều kiện tiêu chuẩn Tính a
số mol của 11,2 lít khi Oxi là:
\(n_{O_2}=\dfrac{V}{22,4}=0,5\left(mol\right)\)
Vậy S có khối lượng là:
\(m_S=n.M=0,5.32=16\left(g\right)\)
Đúng 2
Bình luận (0)
Đốt cháy một hỗn hợp bột sắt và Lưu huỳnh có khối lượng 20 gam phải dùng hết 6,72 lít oxi(ở điều kiện tiêu chuẩn)
a.Viết phương trình phản ứng
b. Tính thành phần phần trăm về khối lượng mỗi chất trong hỗn hợp (Giả sử phản ứng chỉ tạo thành các chất khí)
Xem chi tiết
\(n_{Fe}=a\left(mol\right),n_S=b\left(mol\right)\)
\(n_{O_2}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
\(m_{hh}=56a+32b=20\left(g\right)\left(1\right)\)
\(3Fe+2O_2\underrightarrow{t^0}Fe_3O_4\)
\(S+O_2\underrightarrow{t^0}SO_2\)
\(n_{O_2}=\dfrac{2}{3}a+b=0.3\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.3,b=0.1\)
\(\%Fe=\dfrac{0.3\cdot56}{20}\cdot100\%=84\%\)
\(\%S=16\%\)
Đúng 2
Bình luận (2)