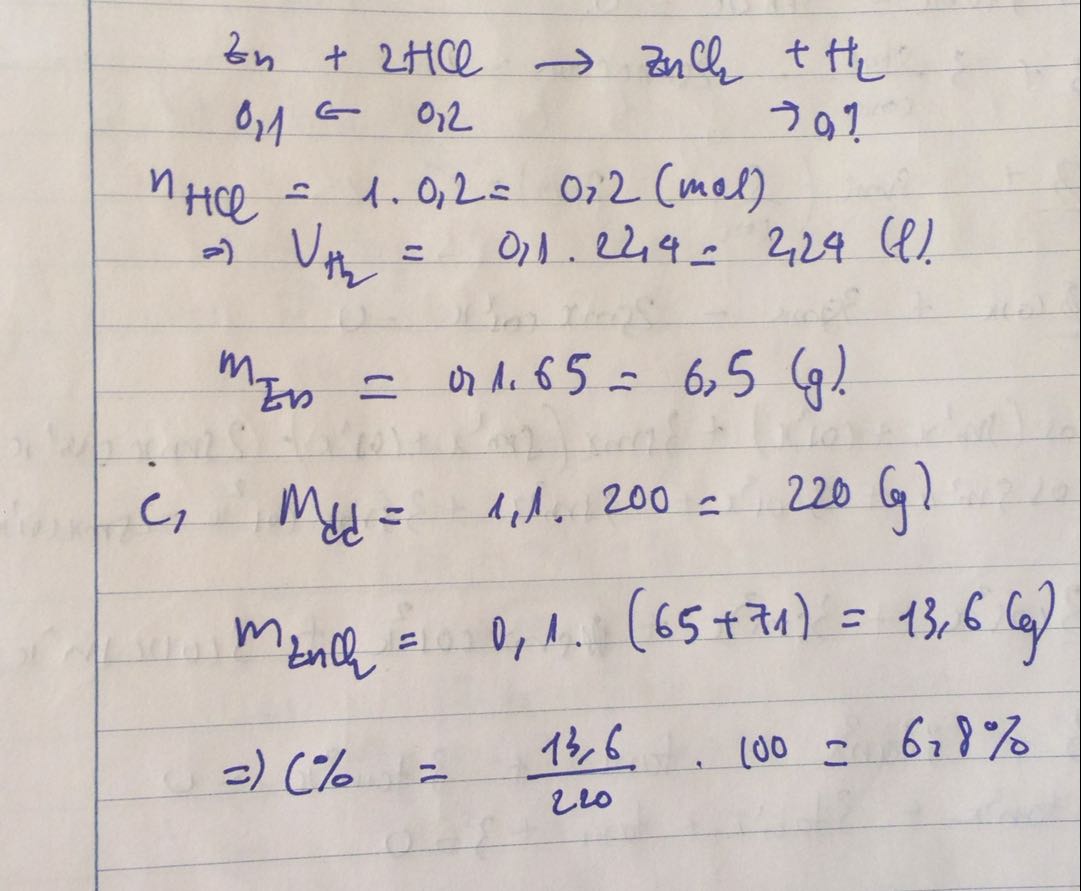Cho sắt tác dụng với 200ml dd axit clohiđric 0,75M a) Viết PTHH của phản ứng b) Tính thể tích khí hiđro thu đc(đktc) c) Tính khối lượng muối tạo thành Giúp mik câu này với :((

Những câu hỏi liên quan
Cho 5,6 gam sắt tác dụng với dung dịch có chứa 0,4 mol axit clohidric thu được muối sắt (II) clorua và khí hiđro a. Viết PTHH của phản ứng xảy ra? b. Tính thể tích khí hiđro thu được (ở đktc) c. Tính khối lượng muối sắt (II) clorua tạo thành ?
a) nFe=0,1(mol); nHCl=0,4(mol)
PTHH: Fe + 2 HCl -> FeCl2 + H2
Ta có: 0,1/1 < 0,4/2
=> Fe hết, HCl dư, tish theo nFe.
b) nH2=nFeCl2=Fe=0,1(mol)
=> V(H2,đktc)=0,1.22,4=2,24(l)
c) mFeCl2=127.0,1=12,7(g)
Đúng 4
Bình luận (0)
a) nFe=0,1(mol); nHCl=0,4(mol) PTHH: Fe + 2 HCl -> FeCl2 + H2 Ta có: 0,1/1 < 0,4/2 => Fe hết, HCl dư, tish theo nFe. b) nH2=nFeCl2=Fe=0,1(mol) => V(H2,đktc)=0,1.22,4=2,24(l) c) mFeCl2=127.0,1=12,7(g)
Đúng 1
Bình luận (0)
Cho 22,4g sắt tác dụng với 300 ml dung dịch axit clohiđric 2M thu được muối sắt (II) clorua) và khí hiđro. a. Viết PTHH của phản ứng. b. Tính khối lượng muối sắt (II) clorua tạo thành c. Tính khối lượng chất còn dư sau phản ứng
`a)PTHH:`
`Fe + 2HCl -> FeCl_2 + H_2`
`0,3` `0,6` `0,3` `0,3` `(mol)`
`n_[Fe]=[22,4]/56=0,4(mol)`
`n_[HCl]=0,3.2=0,6(mol)`
Ta có:`[0,4]/1 > [0,6]/2`
`=>Fe` dư
`b)m_[FeCl_2]=0,3.127=38,1(g)`
`c)m_[Fe(dư)]=(0,4-0,3).56=5,6(g)`
Đúng 5
Bình luận (3)
\(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\\
n_{HCl}=0,3.2=0,6\left(mol\right)\\
pthh:Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\\
LTL:\dfrac{0,4}{1}>\dfrac{0,6}{2}\)
=> Fe dư
\(n_{FeCl_2}=\dfrac{1}{2}n_{HCl}=0,3\left(mol\right)\\
m_{FeCl_2}=0,3.127=38,1\left(g\right)\\
n_{Fe\left(p\text{ư}\right)}=\dfrac{1}{2}n_{HCl}=0,3\left(mol\right)\\
m_{Fe\left(d\right)}=\left(0,4-0,3\right).56=5,6\left(g\right)\)
Đúng 3
Bình luận (0)
\(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\)
\(n_{HCl}=0,3.2=0,6\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
Xét: \(\dfrac{0,4}{1}>\dfrac{0,6}{2}\) ( mol )
0,3 0,6 0,3 ( mol )
\(m_{FeCl_2}=0,3.127=38,1\left(g\right)\)
\(m_{Fe\left(dư\right)}=\left(0,4-0,3\right).56=5,6\left(g\right)\)
Đúng 3
Bình luận (0)
Xem thêm câu trả lời
Cho 5,4 g sắt tác dụng với đ có chứa 0.4 mol axit clohiđric thu đc muối sắt (II)clorua và khí Hidro
a, Viết PTHH của phản ứng sảy ra
b, Tính thể tích Hidro thu đc ở (đktc)?
c,tính số mol muối sắt (II)clorua tạo thành ?
a) Fe + 2HCl --> FeCl2 + H2
b) \(n_{Fe}=\dfrac{5,4}{56}=\dfrac{27}{280}\left(mol\right)\)
Fe + 2HCl --> FeCl2 + H2
Xét tỉ lệ: \(\dfrac{\dfrac{27}{280}}{1}< \dfrac{0,4}{2}\) => Fe hết, HCl dư
Fe + 2HCl --> FeCl2 + H2
\(\dfrac{27}{280}\)----------->\(\dfrac{27}{280}\)-->\(\dfrac{27}{280}\)
=> VH2 = \(\dfrac{27}{280}.22,4=2,16\left(l\right)\)
c) \(n_{FeCl_2}=\dfrac{27}{280}\left(mol\right)\)
Đúng 2
Bình luận (0)
Cho 8,1 gam nhôm tác dụng vừa đủ với axit clohiđric (HCl) tạo thành muối nhôm clorua (AlCl3) và khí hiđro a. Viết PTHH xảy ra ?b. Tính thể tích khí hiđro thu được (đktc) ?c. Tính khối lượng muối nhôm clorua tạo thành ?d. Cho toàn bộ lượng H2 thu được ở trên đi qua 32g sắt(III)oxit nung nóng. Tính khối lượng sắt sinh ra ?
Đọc tiếp
Cho 8,1 gam nhôm tác dụng vừa đủ với axit clohiđric (HCl) tạo thành muối nhôm clorua (AlCl3) và khí hiđro
a. Viết PTHH xảy ra ?
b. Tính thể tích khí hiđro thu được (đktc) ?
c. Tính khối lượng muối nhôm clorua tạo thành ?
d. Cho toàn bộ lượng H2 thu được ở trên đi qua 32g sắt(III)oxit nung nóng. Tính khối lượng sắt sinh ra ?
a, \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
b, \(n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
\(n_{H_2}=\dfrac{3}{2}n_{Al}=0,45\left(mol\right)\Rightarrow V_{H_2}=0,45.22,4=10,08\left(l\right)\)
c, \(n_{AlCl_3}=n_{Al}=0,3\left(mol\right)\Rightarrow m_{AlCl_3}=0,3.133,5=40,05\left(g\right)\)
d, \(n_{Fe_2O_3}=\dfrac{32}{160}=0,2\left(mol\right)\)
PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Có: \(\dfrac{0,2}{1}>\dfrac{0,45}{3}\) → Fe2O3 dư.
\(n_{Fe}=\dfrac{2}{3}n_{H_2}=0,3\left(mol\right)\Rightarrow m_{Fe}=0,3.56=16,8\left(g\right)\)
Đúng 3
Bình luận (0)
Cho 11,2g sắt (Fe) tác dụng vừa đủ với 200ml dung dịch axit sunfuric (H2SO4). Sau phản ứng thu được muối sắt (||) sunfat(H2SO4) và khí hiđro bay lên. a/ Viết PTHH của phản ứng xảy ra. b/ Tính khối lượng muối sắt (||) sunfat thu được. c/Tính thể tích khí hiđro sinh ra ở (đktc). d/Tính nồng độ mol của dung dịch H2SO4 đã tham gia phản ứng.
a, \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b, \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Theo PT: \(n_{FeSO_4}=n_{Fe}=0,2\left(mol\right)\Rightarrow m_{FeSO_4}=0,2.152=30,4\left(g\right)\)
c, \(n_{H_2}=n_{Fe}=0,2\left(mol\right)\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)
d, \(n_{H_2SO_4}=n_{Fe}=0,2\left(mol\right)\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,2}{0,2}=1\left(M\right)\)
Đúng 2
Bình luận (0)
Cho kẽm tác dụng với 200ml dd axit clohiđric 0,75M Tính khối lượng muối tạo thành câu cuối r mn giúp mik với
\(n_{HCl}=0,2.0,75=0,15mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,15 0,075 ( mol )
\(m_{ZnCl_2}=0,075.136=10,2g\)
Đúng 3
Bình luận (0)
\(n_{HCl}=0,75.0,2=0,15\left(mol\right)\\
pthh:Zn+2HCl\rightarrow ZnCl_2+H_2\\
\)
0,15 0,075
\(m_{ZnCl_2}=0,075.136=10,2\left(g\right)\)
Đúng 2
Bình luận (0)
Cho 5,6 gam sắt tác dụng với dung dịch có chứa 0,4 mol axit clohiđric thu được muối
Sắt(II) clorua và khí hiđro
a) Viết phương trình hóa học của phản ứng xảy ra
b) Thể tích khí hiđro thu được (ở đktc)
c) Tính số mol muối sắt (II) clorua tạo thành?
\(n_{Fe}=\dfrac{5,6}{56}=0,1mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,1 < 0,4 ( mol )
0,1 0,1 ( mol )
\(V_{H_2}=0,1.22,4=2,24l\)
\(n_{ZnCl_2}=\dfrac{0,1.1}{1}=0,1mol\)
Đúng 1
Bình luận (0)
Cho a gam sắt tác dụng vừa đủ với 500ml dung dịch axit clohiđric có nồng độ 0,2M a; viết phương trình phản ứng b; Xác định a c; tính thể tích khí hiđro ở đktc d; tính khối lượng muối thu được sau phản ứng
500ml = 0,5l
\(n_{HCl}=0,2.0,5=0,1\left(mol\right)\)
a) Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,05 0,1 0,05 0,05
b) \(n_{Fe}=\dfrac{0,1.1}{2}=0,05\left(mol\right)\)
⇒ \(m_{Fe}=0,05.56=2,8\left(g\right)\)
c) \(n_{H2}=\dfrac{0,1.1}{2}=0,05\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,05.22,4=1,12\left(l\right)\)
d) \(n_{FeCl2}=\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
⇒ \(m_{FeCl2}=0,05.127=6,35\left(g\right)\)
Chúc bạn học tốt
Đúng 5
Bình luận (0)
nHCl = 0,5.0,2= 0,1(mol)
a) Fe + 2HCl → FeCl2+ H2
0,05 ← 0,1 → 0,05 →0,05
b) mFe = 0,05.56=2,8(gam)
c) VH2= 0,05 .22,4 =1,12 (lít)
d) mFeCl2 = 0,05.(56+35,5.2)=6,35(gam)
Đúng 0
Bình luận (0)
Cho Magie tác dụng với 250ml dd axit sunfuric 0,2M a) Viết PTHH của phản ứng b) Tính khối lượng muối tạo thành Giúp mik câu này với :((
\(n_{H_2SO_4}=0,2.0,25=0,05mol\)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
0,05 0,05 ( mol )
\(m_{MgSO_4}=0,05.120=6g\)
Đúng 1
Bình luận (0)